某化学课外活动小组在实验室配制石灰水时,因发现烧杯底部有固体未溶解,对熟石灰样品的主要成分进行了探究.请你参与讨论并完成实验报告.
【提出问题】针对该熟石灰样品的成分,同学们展开了讨论,小明认为溶解后剩余固体为变质后的难溶性物质,变质的化学方程式为 。小华同学不同意他的判断,你认为小华同学的理由是 。
【进行猜想】猜想一:熟石灰样品成分是Ca(OH)2;
猜想二:熟石灰样品成分是CaCO3;
猜想三:你认为熟石灰样品成分还可能是 。
【实验与结论】请你通过实验验证你的猜想:
【拓展与应用】实验小组同学想测定样品中Ca(OH)2的质量分数:称取上述0.5g样品,加足量水使之充分溶解,搅拌后过滤.
①甲组在实验室用pH试纸和配制好的10%盐酸溶液进行实验,实验数据记录见下表.(提示:氯化钙溶液呈中性)
| 加入盐酸溶液的质量/g |
0 |
2.5 |
3.65 |
6 |
| 样品的pH |
12 |
11 |
7 |
2 |
I.边滴加稀盐酸,边不断搅拌的目的是 ;
II.样品中Ca(OH)2的质量分数是多少?(写出计算过程,4分)
②乙组同学进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图象如下图.则图中a点表示的含义是 ;
图中b点溶液中含有的溶质有 (填化学式),乙组同学要计算出样品中氢氧化钙的质量分数,除了要用到已有数据外,你认为还需要的数据是 。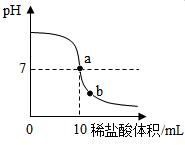
为了探究物质在化学变化时,参加反应的反应物总质量与生成物总质量是否相等.甲、乙两个兴趣小组分别设计了如图所示的实验来验证自己的假设.
【查找资料】有关反应的化学方程式:
甲组:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4;乙组:Na2CO3+2HCl═2NaCl+H2O+CO2↑
【实验方案】
【进行实验】甲小组把盛有适量NaOH溶液的小试管放入盛有CuSO4溶液的烧杯中,乙小组把盛有适量稀盐酸的小试管放入盛有a2CO3溶液的烧杯中.然后他们分别将烧杯放到天平上,用砝码平衡,接着取下烧杯并将其倾斜,使试管内的溶液和烧杯内的溶液混合发生反应,待反应后再把烧杯放在天平上,观察天平是否平衡.请回答:
【实验现象】反应后,甲小组的天平指针指向刻度盘的 ,乙小组的天平指针指向刻度盘的 (选填“左边”、“右边”或“中间”).
【解释和结论】甲小组的结论为: ;
乙小组的解释为: .
【反思与评价】比较两个小组的实验设计,若使用的试剂不变,应改进的是: ;由此,你得到的启示是:探究或验证反应物与生成物的质量关系时,若要用到有气体参加或有气体生成的反应,反应必须在 的容器中进行.
某小组同学进行了有关蜡烛成分测定的实验
| 实验步骤 |
现象 |
结论 |
|
 |
在蜡烛火焰上方罩一个冷而干燥的烧杯 |
烧杯内壁有小液滴 |
产物中有 |
| 将内壁涂有 的烧杯罩在火焰上方 |
|
产物中有二氧化碳 |
由此可知:蜡烛的成分主要由 元素组成,可能还含有 。
化合价是一个重要的化学概念。下面是对元素化合价的部分探究过程。
化学上用“化合价”来表示原子之间____________________。
【提出问题一】元素正负化合价有何规律?
推测一:金属元素都显正价;
推测二:非金属元素只有负价。
【举例及分析一】
(1).NaCl、FeO、Al2O3中金属元素化合价分别为+1、+2、+3,其他金属也都显正价,推测一正确。金属都显正价的可能原因为________________________。
(2).H2O、SO2、CO2中H、O、S、C元素的化合价分别为+1、-2、+4、+4,说明推测二__________(填“成立”或“不成立”)。
(3).金属元素与非金属元素形成化合物时,非金属元素显___________价。
【提出问题二】一种元素只有一种化合价吗?
推测一:一种元素只有一种化合价;
推测二:_____________________________。
【举例及分析二】
(1).NaCl、NaOH、NaNO3、Na2SO4等物质中Na元素都显+1价,推测一成立。
(2).H2S、SO2、SO3、H2SO3等物质中S元素化合不同,S元素化合价分别为-2、+4、+6、___________价。推测二成立。
【结论二】推测一、二都有道理,通过上述举例分析及结合教材上所给元素的化合价,可知__________。
【提出问题三】在同种化合物中,同种元素一定具有相同的化合价吗?
推测一:在同种化合物中,同种元素一定具有相同的化合价;
推测二:在同种化合物中,同种元素不一定具有相同的化合价。
【举例及分析三】NH4NO3中N元素的化合价分别为___________、___________。
【结论三】推测二成立。
为了探究分子的运动性,小强进行下面的实验:
步骤一:如下图所示: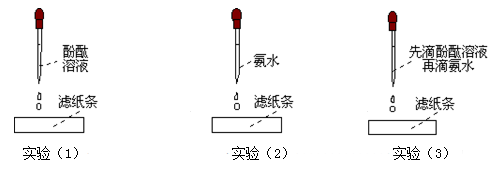
问题:Ⅰ:实验(3)中,滤纸条的变化情况是: 。
Ⅱ:分析上面三个实验的现象,简单解释滤纸变红的原因? 。
步骤二:小强用剪刀在滤纸上剪取一条长滤纸,并在滤纸条上间隔地滴入酚酞溶液,然后放进试管里。最后用蘸有浓氨水的棉花团塞住试管(如右图所示),观察现象。
问题:Ⅰ:上面实验观察到的现象是 ,说明分子 。
Ⅱ:该实验还说明浓氨水的物理性质有 。
反思与交流:
(1)步骤一在整个探究实验中所起的作用是 ,三个实验中没必要做的实验是 。
(2)有人说:“在实验步骤一中,要获得‘酚酞遇氨水变红’这个结论不是很严密,因为滤纸变红,有可能跟滤纸中某种化学成分有关。具体地说,有可能是酚酞跟氨水作用,生成的某种物质再跟滤纸中的该种化学成分发生作用而使滤纸变红。”
你同意上面说法吗?答: 。为了验证他(她)的说法,你补做的实验是(请简单写出实验过程) 。
按照体积计算空气中氧气约占 %,某化学兴趣小组的同学按照课本的实验装置做“测定空气中氧气的体积分数”实验(图1),但测出的氧气体积分数明显偏小.请你参与探究: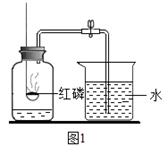
【提出问题】
造成误差的原因是什么?如何改进课本实验装置?
【查阅资料】
①
| 颜色、状态 |
熔点/℃ |
燃烧所需最低温度/℃ |
密度/g•cm﹣3 |
|
| 红磷 |
暗红色固体 |
590 |
240 |
2.34 |
| 白磷 |
白色固体 |
44.1 |
40 |
1.82 |
②二氧化碳气体能被氢氧化钠溶液吸收
③在加热的条件下铜粉能与氧气反应生成黑色的氧化铜固体
【猜想】
甲同学:可能是导管内原存有空气,后来留有吸入的水,影响实验的准确性;
乙同学:可能是瓶内残留气体中还有氧气的缘故;
你还能做的猜想是 (写一点即可)。
【交流与讨论】
(1)写出图1中集气瓶中发生反应的文字或符号表达式 ;
(2)丙同学认为,用木炭代替红磷也能完成图1的实验,但事先要在集气瓶中放入一定量的 ;
(3)他们对图1实验装置进行了如图2的改进.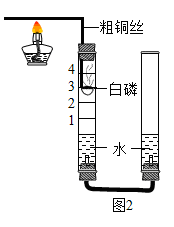
①甲同学提出应把红磷更换为白磷,理由是 ;
②通过粗铜丝来点燃玻璃管内的白磷,利用了金属铜的 性;
③与图1实验装置相比,图2装置的一个优点是 ;
【探究与反思】
(1)为验证乙同学的猜想,将铜粉在残余气体中加热,观察到铜粉变黑,所以乙同学的猜想 (选填“合理”或“不合理”);
(2)大家采用改进的实验装置(图2)进行实验(左边玻璃管上面的空气平均分成了5等份,并标刻度线),待玻璃管冷却、管内白色的烟幕消失,同时能观察到 ,得到了较准确的数据,但又意外发现左玻璃管内壁上端附着白色固体.左玻璃管上端的白色固体主要成分可能是 。