化合价是一个重要的化学概念。下面是对元素化合价的部分探究过程。
化学上用“化合价”来表示原子之间____________________。
【提出问题一】元素正负化合价有何规律?
推测一:金属元素都显正价;
推测二:非金属元素只有负价。
【举例及分析一】
(1).NaCl、FeO、Al2O3中金属元素化合价分别为+1、+2、+3,其他金属也都显正价,推测一正确。金属都显正价的可能原因为________________________。
(2).H2O、SO2、CO2中H、O、S、C元素的化合价分别为+1、-2、+4、+4,说明推测二__________(填“成立”或“不成立”)。
(3).金属元素与非金属元素形成化合物时,非金属元素显___________价。
【提出问题二】一种元素只有一种化合价吗?
推测一:一种元素只有一种化合价;
推测二:_____________________________。
【举例及分析二】
(1).NaCl、NaOH、NaNO3、Na2SO4等物质中Na元素都显+1价,推测一成立。
(2).H2S、SO2、SO3、H2SO3等物质中S元素化合不同,S元素化合价分别为-2、+4、+6、___________价。推测二成立。
【结论二】推测一、二都有道理,通过上述举例分析及结合教材上所给元素的化合价,可知__________。
【提出问题三】在同种化合物中,同种元素一定具有相同的化合价吗?
推测一:在同种化合物中,同种元素一定具有相同的化合价;
推测二:在同种化合物中,同种元素不一定具有相同的化合价。
【举例及分析三】NH4NO3中N元素的化合价分别为___________、___________。
【结论三】推测二成立。
课外小组同学在实验室进行一氧化碳还原氧化铁的实验。
【查阅资料】
Ⅰ.常温下,甲酸(HCOOH)是无色易挥发的液体,在浓硫酸作用下易分解。
甲酸分解的化学方程式为:HCOOH 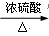 CO↑+ H2O。
CO↑+ H2O。
Ⅱ.铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
【实验设计及操作】
(1)利用下列装置完成用纯净、干燥的一氧化碳还原氧化铁实验,并检验气态产物。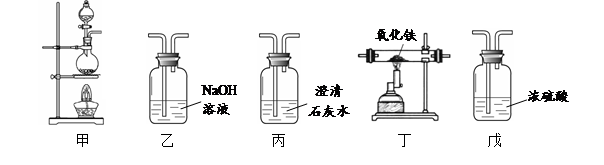
① 若各步均反应完全,装置的连接顺序为_____→尾气处理(填序号)。
② 实验时先点燃甲中的酒精灯,一段时间后再点燃丁中的酒精喷灯,目的是;装置乙的作用是。
③ 装置丁中观察到的现象是_____,反应的化学方程式是_____。
(2)为检验氧化铁是否反应完全,同学们设计如下实验方案:从装置丁中取出少量反应后的固体粉末于试管中,加入足量稀盐酸,若观察到有大量气泡产生且溶液变为浅绿色,则说明氧化铁已完全反应。上述判断是否正确,理由是_____。
根据下图所示实验,回答问题。 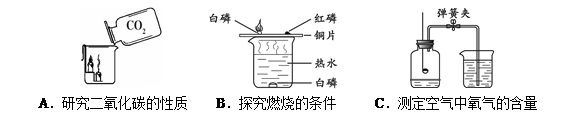
(1)实验A中观察到的现象是,说明相同条件下,CO2的密度比空气大,且。
(2)实验B中只有铜片上的白磷燃烧,由此证明可燃物的燃烧条件是。
(3)实验C中红磷要过量,其目的是,红磷燃烧的化学方程式是。
用木炭还原氧化铜的实验如图.
(1)酒精灯加网罩的目的 ;
(2)刚开始预热,试管②中立即产生气泡,但石灰水不变浑浊,原因是 ;
(3)继续加热,观察到石灰水逐渐变浑浊,黑色粉末中出现红色物质.请你写出发生反应的方程式:、;
(4)停止加热时,待试管①冷却后再把试管里的粉末倒出.这样操作的原因是。
(5)下课后,同学们仔细观察试管里倒出的粉末,发现红色的粉末中还有一些黑色的粉末混杂,有几位同学推测黑色粉末①可能是没有反应完的木炭粉末;②可能是没有反应完的氧化铜粉末;③可能是没有反应完的木炭和氧化铜的混合物。请你设计实验证明推测①成立:(写出具体的实验步骤、现象及结论)
实验室常用的干燥剂“碱石灰”是CaO和NaOH固体的混合物。同学们为确认一瓶久置的“碱石灰”样品的成分,进行如下实验探究。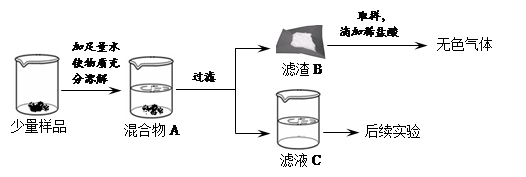
查阅资料:1.Ca(OH)2、Na2CO3溶于水无明显的温度变化。
2.CaCl2+Na2CO3=2NaCl+CaCO3↓。
3.CaCl2溶液呈中性。
(1)滤渣B中一定含有_____,产生该物质的化学方程式可能是_____(写出一个即可)。
(2)滤液C成分的探究。
【猜想】滤液C中的溶质可能为①NaOH;②Na2CO3;③NaOH和Na2CO3;④____。
【设计方案并进行实验】甲、乙、丙同学分别设计如下方案并进行探究:
甲同学:取滤液C少许放入试管中,滴加足量的稀盐酸,产生大量无色气体,则滤液C中的溶质是Na2CO3。
乙同学:取滤液C少许放入试管中,滴加足量的无色酚酞,液体变成红色,则滤液C中的溶质一定含有NaOH。
丙同学:取滤液C少许放入试管中,滴加Ca(OH)2溶液,有白色沉淀产生。向上层清液中滴加无色酚酞,无色酚酞变成红色,则滤液C中的溶质是NaOH和Na2CO3。
【反思与评价】
丁同学认真分析上述三位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断。他认为滤液C中的溶质一定含有____,可能含有NaOH。为进一步确认猜想③正确,请你帮助他设计实验进行验证。
| 实验操作 |
实验现象 |
实验结论 |
| _____ |
_____ |
猜想③正确 |
(3)实验过程中,同学们还发现向样品中加入足量水溶解时放出大量的热。综合对滤液和滤渣成分的探究,下列对样品成分的分析正确的是_____(填序号)。
① 样品中一定含NaOH
② 样品中一定含Na2CO3
③ 样品中含NaOH、CaO中的一种或两种
还原性铁粉在潮湿的空气中容易生锈。现有m1 g生锈的铁粉样品,某兴趣小组同学按下图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理)。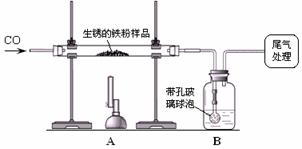
(1)装置A中反应的化学方程式是_____。
(2)某同学欲通过B装置反应前后的质量变化,测定该样品中氧化铁的质量分数。B中的最佳试剂是_____(填序号),实验时B中反应的化学方程式是_____。
① 澄清石灰水② 氢氧化钠浓溶液 ③ 稀盐酸 ④ 水
(3)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:① 实验开始时,排尽装置中的空气,防止加热时发生爆炸;② 停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③_____。
(4)完全反应后,甲同学称得铁粉的质量为m2 g,同时测得装置B增重m3 g,则铁粉样品中氧化铁的质量分数为_____。