有一包黑色粉末,可能由C、CuO、Fe三种物质中的一种或几种组成。某化学兴趣小组为了探究它的成分,按如下步骤进行实验。
(1)先对实验做了如下设想和分析:黑粉中只有碳粉不溶解于稀盐酸。取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,则实验中可能出现的现象与对应结论如下表所示(表中未列完所有情况)。请你完成下表。
| 烧杯中可能出现的现象 |
结论 |
| ① |
只含C |
| ②固体部分溶解,溶液变成蓝色,无气泡 |
|
| ③有黑色不溶物,有气泡逸出,溶液呈浅绿色 |
含C、Fe |
(2)通过实验及分析,确定该粉末为C、CuO的混合物。为了进一步探究C、CuO的性质,他们又利用这种混合物补充做了下面两个实验。
【实验一】将此粉末敞口在空气中灼烧完全,待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。烧杯中 (填“有”或“无”)不溶物,溶液呈 色。
【实验二】将此粉末隔绝空气加热(若碳完全反应),待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。请回答:①烧杯中 (填“有”或“无”)不溶物;②若静置后溶液呈无色,则该溶液中溶质是 (写化学式);③若静置后溶液呈蓝色,该实验过程中所发生反应的化学方程式 、 。
“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【实验探究一】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,催化效果如何?
| 实验步骤 |
实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 |
A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 |
试管中均产生气泡,带火星木条均复燃 |
| III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 |
|
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
【实验结论】
(1)由实验Ⅰ你可以得出的结论是;
(2)实验II、III证明:氧化铁的和在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的符号表达式;
【实验评价】
(4)若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是。
【实验探究二】影响化学反应的速率除了催化剂以外,还有其它因素吗?以下是另一实验小组探究影响反应速率部分因素的相关实验数据。
| 实验序号 |
H2O2溶 液浓度% |
H2O2溶液体积/mL |
温度℃ |
MnO2的用量/g |
收集氧气的体积/mL |
反应所需 的时间/s |
| ① |
5 |
1 |
20 |
0.1 |
4 |
16.75 |
| ② |
15 |
1 |
20 |
0.1 |
4 |
6.04 |
| ③ |
30 |
5 |
35 |
0 |
2 |
49.21 |
| ④ |
30 |
5 |
55 |
0 |
2 |
10.76 |
(5)通过实验①和②对比可知,化学反应速率还与有关;从实验和对比可知,化学反应速率与温度的关系是:;
(6)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:。
有人提出运用高科技可以使水变成汽油,小明认为可以用物质组成的观点揭开这个骗局。以下是小明的实验探究过程。
【提出问题】根据水的组成和汽油的组成判断,水是否可以变成汽油?
【猜想与验证】(1)探究水的组成。实验装置示意图如图: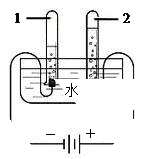
|
通电一段时间后,经过检验可知,试管1中的气体是 。该反应的符号表达式为 。
该实验说明:水是由 组成的(写名称)。| 实验步骤 |
实验现象和化学方程式 |
实验目的 |
| ①点燃使用汽油作燃料的油灯 |
||
| ②将光洁干冷的小烧杯罩在油灯火焰的上方 |
现象:小烧杯内壁出现小水珠 |
证明汽油在空气中燃烧后的产物中有水 |
| ③将内壁蘸有 的小烧杯罩在油灯火焰的上方 |
现象: |
证明汽油在空气中燃烧后的产物中有二氧化碳 |
该实验说明:汽油的组成中肯定含有的元素有 (写元素符号)。
【得出结论】因为汽油和水的组成元素不同,所以水不能变成汽油。
下列图( I )是部分常用化学仪器或装置,图(Ⅱ)是部分“微型”化学仪器或装置(用 “微型”仪器做实验,其试剂用量和废物排放量是通常用量的l/10或更少,符合绿色化学的理念)。对比图(I)和图(Ⅱ)回答以下问题:
⑴图( I )中A、B的名称分别是、;
⑵用图(Ⅱ)中的“微型”仪器做实验,固体只需极少量、液体用量也很少(或只需1~2
小滴),相对用图(I)仪器做实验的优点是、、(填序号):
①节约药品用量②能完全消除实验污染
③方便个人或家庭实验④若需加热也能节约燃料
⑶图( I )中的C装置的作用相当于图(II)中的装置(填字母),它们在实
验操作上的共同优点是通过控制来控制反应速度。
用如图所示装置测定空气氧气的含量:在一个具有刻度和可以滑动的活塞的玻璃容器中放入一粒白磷(白磷燃烧所需的最低温度为40℃),将玻璃容器固定好,放在盛有85℃热水的烧杯上。请回答下列问题:
⑴实验中可以看到玻璃容器内白磷燃烧的现象是,该反应的化学(符号)表达式为。
⑵活塞在整个实验中的运动状况是先向,原因是;然后向,最后停在刻度_ ___处。
⑶玻璃容器内余下的气体主要是____,该实验能体现出该气体所具有的化学性质是、。
小明发现一种淡黄色的粉末可以用于杀菌、消毒和漂白,于是想探究该固体的成分。
[提出问题] 该淡黄色固体的化学成分是什么?
[查阅资料]
(1)硫单质是一种淡黄色固体,难溶于水,在空气中点燃硫单质,生成一种无色、有刺激性气味的气体。
(2)过氧化钠(Na2O2)是一种淡黄色固体,能与水反应,生成气体并放出大量的热。
[设计实验方案]
方案一:取少量该固体粉末于试管中,加2mL水,振荡并观察现象。
方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象。
比较以上两方案,你认为的最佳方案是,理由是(从环保、操作等角度分析)。
[实验验证并得出结论]
小明向盛有少量该固体的试管中加入2mL水,立刻观察到有无色气泡产生,并且验证出该反应同时生成了氢氧化钠(NaOH)。通过实验验证,确定该淡黄色粉末为过氧化钠。
小明想对生成的气体成分判断,他提出了以下两种假设:
①该气体是CO②该气体是O2
你认为上述假设哪个更合理?并说明选择的理由。 。
请设计一个实验,验证你的合理假设(写出简要操作步骤、实验现象和结论)。
| 操作步骤 |
实验现象 |
结论 |
[计算] 在过氧化钠(Na2O2)中,①氧元素的化合价为;
②过氧化钠中钠、氧元素的质量比为;
78克过氧化钠与多少克二氧化碳中所含氧元素的质量相等?(列式计算 )