为了探究分子的运动性,小强进行下面的实验:
步骤一:如下图所示:
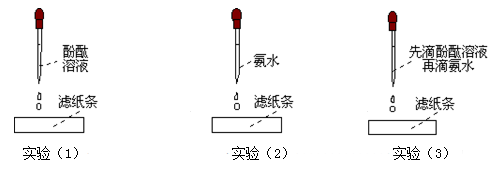
问题:Ⅰ:实验(3)中,滤纸条的变化情况是: 。
Ⅱ:分析上面三个实验的现象,简单解释滤纸变红的原因? 。
步骤二:小强用剪刀在滤纸上剪取一条长滤纸,并在滤纸条上间隔地滴入酚酞溶液,然后放进试管里。最后用蘸有浓氨水的棉花团塞住试管(如右图所示),观察现象。

问题:Ⅰ:上面实验观察到的现象是 ,说明分子 。
Ⅱ:该实验还说明浓氨水的物理性质有 。
反思与交流:
(1)步骤一在整个探究实验中所起的作用是 ,三个实验中没必要做的实验是 。
(2)有人说:“在实验步骤一中,要获得‘酚酞遇氨水变红’这个结论不是很严密,因为滤纸变红,有可能跟滤纸中某种化学成分有关。具体地说,有可能是酚酞跟氨水作用,生成的某种物质再跟滤纸中的该种化学成分发生作用而使滤纸变红。”
你同意上面说法吗?答: 。为了验证他(她)的说法,你补做的实验是(请简单写出实验过程) 。
(8分)CO2是初中化学重点研究的气体之一。某化学兴趣小组设计了如下实验来探究CO2的制取和性质:

(1)该兴趣小组用干燥管、烧杯、铜网等设计装配了一个在实验室中制取二氧化碳气体的装置,如右图所示。在干燥管内的铜网上应盛放 ;若将铜网换成铁网,可能产生的后果是 ,其原因是(用化学方程式表示) 。
(2)该兴趣小组同学将制得的CO2分别通人澄清石灰水和氢氧化钠溶液中,他们观察到前者变浑浊,后者无明显现象。CO2和NaOH是否发生了化学反应?
①小明设计了甲、乙两个实验来验证C02与NaOH发生了化学反应,如右图所示。实验现象为:甲——软塑料瓶变瘪,乙——“瓶吞鸡蛋”。
小虎同学认为上述实验是可行的。其共同原理是 。
小雯同学提出质疑,她认为上述实验还不足以说明CO2和NaOH发生了反应。其理由是
。
小明同学针对小雯的质疑又补充了一个对照实验,这个实验是
。
②小虎向甲实验后变瘪塑料瓶的溶液中加入 ,观察到
现象,从而证明CO2与NaOH已经发生了反应。
(7分)化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:

图1
A B C D E
图2
(1)写出图中带标号仪器的名称:① ② 。
(2)若实验室对你开放,请从图1中选择合适的装置,制取一种你熟悉的气体。你想制取的气体是 ,选择的发生装置是 (填序号,下同),选择的收集装置是 ,选择此收集装置的理由是 。
(3)装置B虽然操作简便,但无法控制反应速率。请从图2中选取 (填序号)取代B中的单孔塞,以达到控制反应速率的目的。
(8分)在日常生活中,我们发现切过咸菜的刀更容易生锈.而除锈用稀盐酸比稀硫酸快。为了进一步验证上述现象,某校师生做了以下相关分组实验,请你根据自己平时课堂学习的体验一起参与讨论并回答相关问题。
【步骤一】未打磨的铝片浸入氯化铜溶液中,迅速产生大量气泡和疏松的紫红色固体,并放热,片刻后溶液由蓝绿色变成无色。
(1)若要正视紫红色固体中是否含有氧化铜,可用▲溶液(填一试剂)加以检验。
【步骤二】未打磨的铝片浸入硫酸铜溶液中,一段时间内没有明显现象。
(2)比较步骤一、二,你能得出的结论是:▲。
【步骤三】打磨过的铝片浸入硫酸铜溶液中,其操作、现象和结论见下表。
(3)试将“影响因素”选项前恰当的字母序号填入答题卡指定位置。
| 实验操作 |
使用现象 |
对比结论 |
| Ⅰ.一片用粗砂纸单向用力打磨3次,将其浸入硫酸铜溶液,片刻后用镊子取出。 |
现象一:粗砂纸打磨的在划痕处有少量气泡,附着少量疏松的紫红色固体。 |
现象一与现象二对比,说明 ①▲ |
| 现象二:粗砂纸打磨的片刻内现象不明显。 |
||
| Ⅱ.一片用特细砂纸往复打磨数次,再将其浸入硫酸铜溶液,片刻后取出。 |
现象三:特细砂纸打磨的表面产生较多细小气泡,表面均匀附着紫红色固体。 |
现象三与现象一对比,说明 ②▲ |
| 现象四:特细砂纸打磨的表面一段时间内没有明显现象。 |
现象四与现象三对比,说明 ③▲ |
★影响因素:
A.打磨时用力程度及均匀程度不同
B.选用砂纸颗粒粗细程度不同
C.由于摩擦生热又形成了新的氧化膜
(4)比较步骤三各实验操作中用砂纸打磨的作用是:▲。
(5)请仔细观察下图: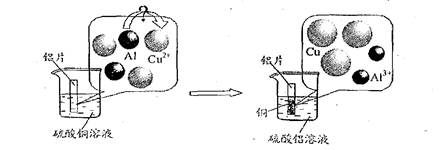
试从微观粒子变化的角度分析该反应的实质是:
▲。
(6分)酸与碱之间发生中和反应,其实质是酸溶液中大量自由移动的H+和碱溶液中大量自由移动的OH-结合成水分子的过程。请根据以下氢氧化钠溶液与稀盐酸反应的实验,回答问题。
【实验1】用酚酞试液
(1)向一锥形瓶中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为(结果精确到0.1%)。反应后溶液中的溶质可用的方法(填一操作名称)使其析出。用酚酞作指示剂可逐滴控制酸、碱溶液反应的量,视觉效果灵敏,操作简便。
【实验2】用pH试纸
(2)向一支试管内倒入约2mL氢氧化钠溶液,再逐滴滴入盐酸,边滴边振荡。然后用玻璃棒蘸取反应液沾到pH试纸上,与标准比色卡对照。因无法通过肉眼观察到反应进程,需间隔数滴多次检测溶液的pH,所以每使用玻璃棒蘸取溶液前,必须进行的预处理。
【小结】
(3)除了用酸碱指示剂、pH试纸外,还可用(填力法)检测中和反应是否发生。
维生素C是生命活动中不可缺少的营养物质,不同的饮料中维生素C的含量不同。下面是小明同学运用学到的实验方法测定橙汁、果味饮料中维生素C的含量。
【实验目的】测定不同饮料中维生素C的含量。
【实验原理】
(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;
(2)淀粉遇到碘水变色。
【实验试剂】碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水
【实验过程】
步骤1:在4支试管中分别盛有3.0 mL的下列物质:①蒸馏水,②标准维生素C溶液,
③橙汁,④果味饮料。分别向4支试管中滴加2滴淀粉溶液。
步骤2:用4支相同的胶头滴管分别向①~④支试管中逐滴滴加碘水至刚好变色,并记录滴数。
【实验记录】
| 测定物质 |
① |
② |
③ |
④ |
| 滴入碘水的数量(滴) |
1 |
8 |
15 |
5 |
试回答下列问题:
(1)你认为小明测定的两种饮料中, 的维生素C的含量较高;
(2)有的同学认为测定物质标准维生素C溶液是多余的,你认为呢?请说明理由:
;
(3)化学实验需要控制变量。下列 (填序号)情况会影响到测定结果。
A.每次实验所用饮料的颜色不同 B.量取的被测试物质的体积不同
C.试管的大小不同 D.没有用同一规格的胶头滴管滴加碘水
【回顾与反思】实验中所用的淀粉溶液的作用是。