A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。(要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度.)
(1)写出化学式:A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为____________;常温下,若B1、B2两溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________;
(3)写出0.1 mol/L的A2溶液中离子浓度大小排序______________________________。
(11分)电解原理在化学工业中有广泛应用。右图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: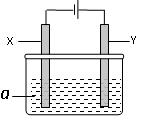
(1)X的电极名称是。
(2)若X、Y都是惰性电极,a是硫酸钠溶液,实验开始时,同时在两边各滴入几滴石蕊试剂,一段时间后,在X极附近观察到的现象是,Y极上的电极反应式为。
(3)若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阳极上产生气体的体积为0.224L(标准状况下),则阴极上析出金属的质量为g。
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是
,Y电极的材料是。
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是。
| 方案 |
X |
Y |
a溶液 |
| A |
银 |
石墨 |
AgNO3 |
| B |
银 |
铁 |
AgNO3 |
| C |
铁 |
银 |
Fe(NO3)3 |
| D |
铁 |
银 |
AgNO3 |
恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应: 2A(g) + B(g)  xC (g) + D(s)C500解质。,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC (g) + D(s)C500解质。,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x =
(2)从反应开始到40s达平衡状态,A的平均反应速率为
(3)平衡时容器中B的体积分数为
(4)该温度下此反应的平衡常数表达式为数值是
(5)下列各项能表示该反应达到平衡状态是
A.消耗A的物质的量与生成D的物质的量之比为2∶ 1
1
B.容器中A、B的物质的量 n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
( 6)在相同温度下,若起始时c(A)="5" mol·L-1,c(B)=6mol·L-1,反应进行一段时间后,测得A的浓度为3mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”)。
6)在相同温度下,若起始时c(A)="5" mol·L-1,c(B)=6mol·L-1,反应进行一段时间后,测得A的浓度为3mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”)。
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_______________________________________ 。
。
(2)铁在潮湿的空气中容易被腐蚀为铁锈( Fe2O3•x H2O),写出铁发生电化学腐蚀时负极的电极反应:____________________________________________。
Fe2O3•x H2O),写出铁发生电化学腐蚀时负极的电极反应:____________________________________________。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,
溶液中发生的化合反应的离子方程式______________________________。
(4)下列各个装置中铁棒被腐蚀由难到易的顺序是_______________________(填字母) 。
(5)写出两种防护铁生锈的方法。
臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
(1)在一定条件下,有aL氧气和臭氧的混合气体,当其中的臭氧完全转化为氧气,体积变为1.2aL,原混合气体中氧气的质量分数为。
(2)若在标况下,在臭氧发生器中装入100mL氧气,最后体积为95mL。最终状态时混合气体的密度是g/L。(保留一位小数)
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应 器中,充分加热后,粉末的质量变为21.6g。原混合气中臭氧的体积分数为__________________。
器中,充分加热后,粉末的质量变为21.6g。原混合气中臭氧的体积分数为__________________。
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋 资源。试回答下列问题:
资源。试回答下列问题:
(1)海水中含有大量的氯化钠。氯化钠中的金属元素化合价为;除去NaCl溶液中的SO42-,可依次加入、 和三种溶液。
和三种溶液。
(2)目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是 将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是(填“物理变化”、
将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是(填“物理变化”、 “化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
“化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐t 。
NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐t 。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法流程如下:
写出反应②③的化学反应方程式:,。