如图,将纯Fe棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是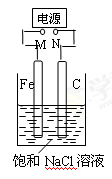
| A.M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况)时,生成1 mol NaOH |
| B.M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红 |
| C.M接负极,N接正极,若把烧杯中溶液换成1 LCuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
| D.M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜 |
下列叙述正确的是
| A.氯化铯晶体中,每1个Cs+与其他8个Cs+等距离紧邻 |
| B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子 |
| C.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
| D.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构 |
已知X、Y是主族元素,I为电离能,单位是KJ/mol。根据下表所列数据判断错误的是
| 元素 |
I1 |
I2 |
I3 |
I4 |
| X |
496 |
4562 |
6912 |
9543 |
| Y |
578 |
1817 |
2745 |
11600 |
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族的元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
下列是几种原子的基态电子排布,电负性最大的原子是
| A.1s22s22p4 |
| B.1s22s22p63s23p3 |
| C.1s22s22p63s23p2 |
| D.1s22s22p63s23p64s2 |
下列说法中正确的是
| A.干冰升华时分子内共价键会发生断裂 |
| B.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
| C.分子晶体的熔沸点低,常温下均呈液态或气态 |
| D.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动 |
下列说法正确的是
| A.最外层电子排布为ns2的元素一定处于周期表IIA族 |
B.主族元素X、Y能形成 型化合物,则X与Y 的原子序数之差可能为2或5 型化合物,则X与Y 的原子序数之差可能为2或5 |
| C.氯化氢的沸点比氟化氢的沸点高 |
| D.同主族元素形成的氧化物的晶体类型均相同 |