(10分)实验室要用12.5 mol/L的浓盐酸配制1.0 mol/L的稀盐酸100 mL。
(1)要配制上述溶液,需用 量取12.5 mol/L的浓盐酸 mL。
(2)配制过程中,除(1)中所选仪器、以及烧杯、玻璃棒、胶头滴管外,还需用到的仪器有 。
(3)A、B是配制溶液时可能用到的二种仪器的一部分,请根据提供的情景按要求回答问题。
若按B中视线观察液面,则还需要继续进行的操作是 ;此操作完毕时,配制溶液的浓度 (填偏高、偏低、相符)。
(1)氮元素基态原子核外未成对电子数为个;
(2)C、N、O三种元素第一电离能从大到小的顺序是_____________;
(3)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个顶点,该晶体中 X、Y、Z的粒子个数比为______________;
(4)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态
电子排布式;葡萄糖分子中碳原子杂化方式有。
(5)某化合物其组成可用CoCl3·5NH3表示。把CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl。请写出表示此配合物结构的化学式(钴的配位数为6)_____________________。
现有下列物质, 用编号填空回答下列各问题:
| A.干冰 | B.金刚石 | C.氩 | D.过氧化钠 E.二氧化硅 F.氯化铵 |
(1)通过非极性键形成的晶体是 。
(2)固态时属于分子晶体的是 。
(3)由原子构成的分子晶体是 。
(4)含有非极性键的离子化合物是 。
(5)含有离子键、共价键、配位键的化合物是 。
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答: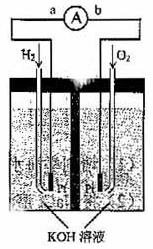
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(用a、b表示)。(2)负极反应式为 。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为 0.82g/cm3。用锂吸收 224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 。
15分)(1)下图所示的模型表示的分子中,可由碳和氢两种元素形成的是。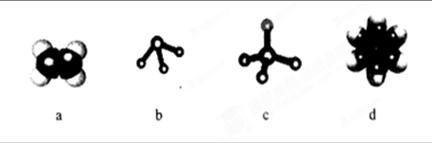
c分子的空间构型为;d分子的结构简式
(2)关于a分子有下列问题:
①如果a分子中的一个氢原子被甲基取代后得到的物质中在同一平面的原子最多有____________个。
②a能使溴的水溶液褪色,该反应的生成物的名称是。
③a与氢气发生加成反应后生成分子e,e在分子组成和结构上相似的有机物有一大类(又称“同系物”),它们均符合通式CnH2n+2,当n=_______时,这类有机物开始出现同分异构体,写出该烷烃可能有的同分异构体结构简式。
(3)苯环结构中,不存在单双键交替结构,可以作为证据的事实是:①苯不能使KMnO4(H+)溶液褪色②苯中碳碳键的键长均相等③苯能在一定条件下跟H2发生加成反应生成环己烷④经实验测得邻二甲苯仅有一种结构⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不能因化学变化而使溴水褪色。其中正确的是
(4)已知乳酸的结构简式为CH3CH(OH)COOH。试回答:
①乳酸分子中含有________和_________两种官能团(写名称);
②乳酸与金属钠反应的化学方程式为
_________________________________________________________________;
③当乳酸和浓硫酸共热时,能产生多种酯类化合物,写出乳酸在一定条件下合成聚酯的化学方程式_________________________________________________________________
下表是元素周期表的一部分,回答下列有关问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||||
| 2 |
① |
② |
||||||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|||||
| 4 |
⑩ |

|
|
⑴.在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同) ,碱性最强的是 ,呈两性的氢氧化物是 ,
⑵.写出工业上冶炼⑤的化学方程式为 ;⑤与一种黑色晶体反应冶炼铁的化学方程式为: 。
⑶.在⑧与⑦中,非金属性较强的元素是 ,写出可以验证该结论的一个离子反应方程式 。