重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
(1)碱浸前将铬铁矿粉碎的作用 。
(2)反应器①中除发生题中所给反应外,请写出其他两个化学方程式(要求两个反应中反应物均不相同) ; 。③中调节PH=7-8所得滤渣为 、 。
(3)从平衡角度分析④中酸化的原理 ;
(4)用简要的文字说明操作⑤加入KCl能得到K2Cr2O7晶体的原因是 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,向其中加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32—=2I—+S4O62—)
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置)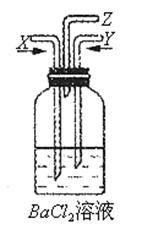
请回答下列问题。
(1)气体X的主要成分有______ ______。(写化学式)
______。(写化学式)
(2)洗 气瓶中的反应现象为_____________。用文字简要解释产生上述实验现象的原因:_______________________。
气瓶中的反应现象为_____________。用文字简要解释产生上述实验现象的原因:_______________________。
(3)管口Z处的现象是_________________,产生此现象的原因是_______________。(用化学方程式表示)
请回答氯碱的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果)。
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO2-4等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是(填序号)。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子腊都只允许阳离子通过。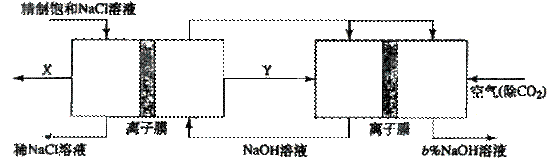
①图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
②分别写出燃料电池B中正极、负极上发生的电极反应
正极:_____________; 负极:_______________;
这样设计的主要节(电)能之处在于(写出2处)____________、____________。
I.某中和滴定实验过程如下:
(1)取一支用蒸馏水洗净的酸式滴定管,加入标准的盐酸溶液,记录初始读数
(2)用碱式滴定管放出一定量待测液,置于未用待测液润洗的锥形瓶中,加入酚酞2滴
(3)滴定时,边滴加边振荡,同时注视滴定管内液面的变化
(4)当滴到溶液由红色变为无色,颜色稳定后停止滴定,记录液面读数
请选出上述实验过程中的错误之处(填序号)。
II.某烧碱溶液中含有少量杂质(不与盐酸反应),现用盐酸溶液测定其浓度。
(1)滴定:下图表示某次滴定时50 mL酸式滴定管中前后液面的位置,请将相关数据填入下表空格中。
| 滴定序号 |
待测液体积 (mL) |
所消耗盐酸体积(mL)(滴定前) |
所消耗盐酸体积(mL)(滴定后) |
所消耗盐酸体积(mL) |
| 1 |
25.00 |
0.50 |
25.12 |
24.62 |
| 2 |
25.00 |
|||
| 3 |
25.00 |
6.00 |
30.58 |
24.58 |
(2)盐酸浓度为0.1000mol/L。根据所给数据,计算样品中烧碱的物质的量浓度c = 。
(3)下列几种情况所测烧碱浓度与实际浓度相比:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则测定结果;
b.酸式滴定管读数时,若滴定前仰视,滴定后俯视,则测定结果;
c.酸式滴定管中滴定前有气泡,滴定后气泡消失,则测定结果;
III.向25mL 0.1mol/L NaOH 溶液中加入25mL 0.2mol/L CH3COOH溶液,充分反应后
(pH<7),溶液中下列微粒:Na+,OH-,CH3COO-,H+,CH3COOH的浓度由大到小的顺序为。
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是。(2)装置E中的现象是。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
① 步骤I中通入Cl2的作用是。② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
③ 该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
下图是用0.1000 mol/L的盐酸滴定某未知浓度的 NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
⑴ 仪器A的名称是;
⑵ 盐酸的体积读数:滴定前读数为mL,滴定后读数为mL 。
⑶ 某实验小组同学的三次实验的实验数据如下表所示。 根据表中数据计算出的待测NaOH溶液的平均浓度是mol/L。(保留四位有效数字)

| 实验 编号 |
待测NaOH溶液的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 |
20.00 |
1.20 |
23.22 |
| 2 |
20.00 |
2.21 |
24.21 |
| 3 |
20.00 |
1.50 |
23.48 |
⑷ 滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
| A.用碱式滴定管向锥形瓶里注入20.00 mL待测NaOH溶液,并加入2~3滴酚酞; |
| B.用标准溶液润洗酸式滴定管2~3次; |
| C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡; |
| D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3 cm; |
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)________
⑸用标准盐酸滴定待测烧碱溶液,滴定时____手旋转酸式滴定管的,_______手不停地向同一方向摇动锥形瓶,两眼注视,直到为止,可判断滴定到达终点。