已知草酸为二元弱酸:
H2C2O4 HC2O4-+H+ Ka1
HC2O4-+H+ Ka1
HC2O4- C2O42-+H+ Ka2
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
| A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4) |
| B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000 |
| C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液 |
| D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大 |
用NA代表阿伏加德罗常数,下列说法正确的是()
| A.12g金刚石中所含的共价键数为4NA |
| B.标准状况下,11.2L SO3所含的氧原子数为1.5NA |
| C.常温下,1L0.1mol/L的NH4NO3溶液中铵根离子为0.1 NA |
D.1mol 过氧化氢分解转移NA电子 |
下列有关物质的性质叙述不正确的是()
| A.蛋白质水解的最终产物都是α—氨基酸 |
| B.臭氧可用于自来水的消毒,是由于臭氧具有强的氧化性 |
| C.工业上生产氨气时可以用分离出氨气的方法提高转化率,是利用氨易液化的性质 |
| D.氧化铝能与氢氧化钠溶液反应,又能与盐酸反应,是因为氧化铝是两性氧化物 |
下列化学用语表达正确的是()
A.氯化钠的电子式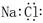 : : |
B.丙烷分子的比例模型: |
| C.NaHCO3的电离方程式NaHCO3=Na++H++CO32- |
| D.质子数为53,中子数为78的碘原子:131 53I |
生活中的一些问题常涉及到化学知识,下列叙述不正确的是()
| A.维生素C具有还原性,在人体内起抗氧化作用 |
| B.“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子 |
| C.日本大地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情。 |
| D.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁。 |
某同学用下列装置制备并检验Cl2的性质。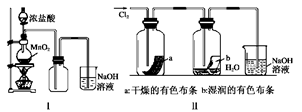
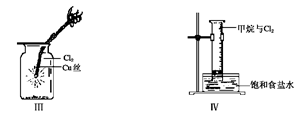
下列说法正确的是( )
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 |
| B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
| C.Ⅲ图中:生成蓝色的烟 |
| D.Ⅳ图中:量筒中发生了加成反应 |