某实验小组利用下图所示实验装置,使氢气平缓地通过装有金属钙的硬质玻璃管制取氢化钙,并分析产品的成分及纯度。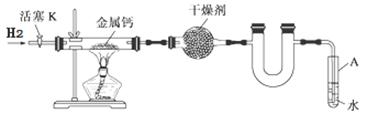
(1)试管A的作用有 ; 。
(2)请将下列制备氢化钙的操作步骤补充完整:
①打开活塞K通入H2;
② ;
③点燃酒精灯,进行反应;
④反应结束后, ;
⑤拆除装置,取出产物。
(3)经分析,产品中只含钙、氢两种元素。取少量产品,小心加入水中,观察到有气泡冒出,滴入一滴酚酞试液,溶液变红。反应的化学方程式可能有CaH2+2H2O=Ca(OH)2+2H2↑、 。
(4)取2.30 g产品溶于蒸馏水,配成500 mL溶液;取25.00 mL该溶液于锥形瓶中,滴入2滴酚酞试液,用0.2500 mol/L 盐酸滴定;三次平行实验,平均消耗盐酸22.00 mL。
①配制溶液所用的玻璃仪器有胶头滴管、烧杯、玻璃棒、量筒、 ;
②判断滴定终点的方法是 ;
③产品中两种成分物质的量之比为 。
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应。小组同学改进了右图所示的装置进行实验(已知制取SO2的反应为H2SO4+Na2SO3=Na2SO4+SO2↑+H2O)。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。试回答下列问题:
(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,
理由_____________________________;
②措施:_________________________________,
理由______________________________________。
(2)某同学推断该白色固体为Na2SO3,则其所类比的化学反应是_____________________(用化学方程式表示)。任何的推论都要经过检验,请完成对白色固体的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、试管夹;3 mol·L-1HCl、6 mol·L-1HNO3、NaOH稀溶液、蒸馏水、1 mol·L-1 BaCl2溶液。
①提出合理假设:
假设1: ;假设2: ;
假设3: ;
②设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1: |
|
| 步骤2: |
|
| … |
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计以下实验方案进行探究。填写下列空白。
[实验方案]铝镁合金粉末 测定剩余固体质量
测定剩余固体质量
[实验步骤]
步骤1:称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L—1NaOH溶液中,充分反应。
步骤2:过滤、洗涤、干燥、称量固体。
[交流与讨论]
(1) 实验中发生反应的化学方程式是;
(2)参与反应的NaOH溶液的体积V≥;
(3)步骤2中,如果经两次过滤滤液仍浑浊,则原因可能是_________(只填一点);
(4)步骤2中,若未洗涤固体,测得镁的质量分数将(填“偏高”或“偏低”)。
[实验拓展] 请你另设计一个实验方案(用上述方案的试剂),测定该铝镁合金中镁的质量分数。
要求:从下图中挑选所需的仪器,画出该方案的实验装置简图(添加必要的塞子、玻璃导管、胶皮管,固定装置不用画),并标明所用试剂.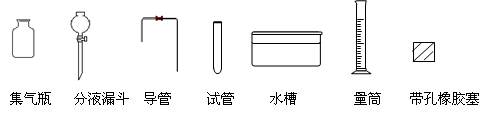

硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,商品名为莫尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了。三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
70 |
| (NH4)2SO4 |
73.0 |
75.4 |
78.0 |
81.0 |
84.5 |
91.9 |
| FeSO4·7H2O |
40.0 |
48.0 |
60.0 |
73.3 |
- |
- |
| (NH4)2SO4•FeSO4•6H2O |
17.2 |
26.4 |
33.0 |
46.0 |
— |
— |
(一)实验室制取少量莫尔盐的流程如下: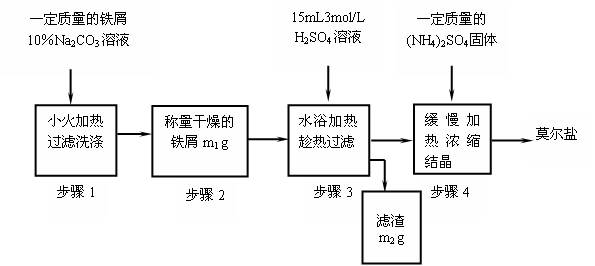
试回答下列问题:
(1)步骤1中加入10%Na2CO3溶液的主要作用是除去铁屑表面的油污,简述其除去油污的原理
(2)将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机
(3)步骤4中析出的晶体不含(NH4)2SO4和FeSO4的原因是,理论上制得的莫尔盐的质量为。
(二)称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。
(1)滴定时,将KMnO4酸性溶液装在_______(填“酸式”或“碱式”)滴定管。试写出该滴定过程中的离子方程式:_____;
(2)判断该反应到达滴定终点的现象为;
(3)假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为mol/L
重晶石矿的主要成分为硫酸钡,纯净的硫酸钡才能供医用作“钡餐”,在对某些内脏器官进行X射线透视时服用。硫化钡是可溶于水的盐。讨论用重晶石矿制硫酸钡,设计流程如下: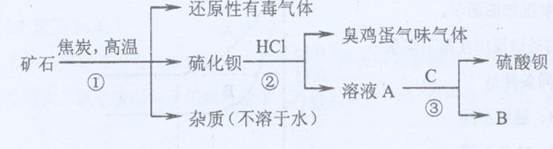 (1)写出步骤①的化学反应方程式,该反应产生的气体具有、等用途。
(1)写出步骤①的化学反应方程式,该反应产生的气体具有、等用途。
(2)为进行②反应先要分离出硫化钡溶液,采用的方法是。在此之前要在溶液中滴入少量Ba(OH)2溶液,其作用是。
(3)若B物质在该生产过程中可循环使用,则③反应的化学方程式是:。
(4)有人提出②反应产生了有臭有毒的气体,可采用改变反应物的方法使无该气体产生,则②反应的化学方程式是:。此时若要B物质还能循环使用,则C为(写化学式)。
(5)BaSO4是因为具有、等性质而可用作“钡餐”的。
化学兴趣小组对用铜制取硫酸铜晶体的实验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中置一些铂丝,反应速率明显加快。此时,其他组的同学提出方案如下:
(1)甲组实验可用一个化学反应方程式表示为,使反应变快的可能原因是。
(2)在五个方案中,科学性有错的是组方案,经济性最差的是组方案。
(3)可持续发展的原则要求化工生产①能耗尽量低,这应排除使用组方案;②无污染,这应排除组方案。
(4)相对能耗低,污染小的是组方案。该给从反应器中排出的溶液中(含有少量H2SO4以抑制水解)取得产品的实验操作步骤应为、、,对取得产品后残留物质的处理方法是。