(14分,每空2分))镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: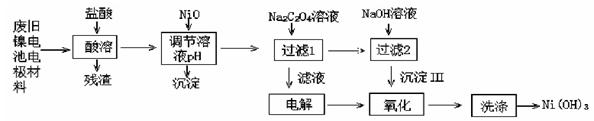
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4> NiC2O4·H2O > NiC2O4·2H2O
③Ksp[Ni(OH)2]=5.0×10-16, Ksp(NiC2O4)=5.0×10-10;
回答下列问题:
(1)酸溶后所留残渣的主要成分为 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为 (填化学式)。
(3)写出加入Na2C2O4溶液后反应的化学方程式: 。
(4)写出加入NaOH溶液所发生反应的离子方程式: 。
(5)电解过程中阴极反应式 ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式 。
(6)铁镍蓄电池,放电时总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
未知物A的实验式和分子式都是C2H6O。A的红外光谱图如图(a),未知物A的核磁共振氢谱有三个峰如图(b),峰面积之比是1∶2∶3,未知物A的结构简式为____________。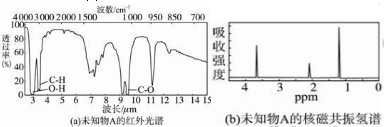
下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。 
请按要求回答:
(1)写出B的化学式______________,G的电子式______________________。
(2)反应①的离子方程式为________________________________________。
(3)反应②进行的条件是__________________________,________________________。
(4)反应③的化学方程式为_______________________________________________。
烷烃分子中的基团—CH3、—CH2—、 、
、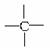 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示。例如
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示。例如 
分子中,N1=6,N2=1,N3=2,N4=1。试根据不同烷烃的组成结构,分析烷烃(除甲烷外)中各原子数的关系。
(1)烷烃分子中氢原子数N0与N1、N2、N3、N4之间的关系是N0=__________。
(2)四种碳原子数之间的关系为N1=__________。
(3)若分子中N2=N3=N4=1,则该分子的结构简式可能为(任写一种)__________。
(4)烷烃分子可看成由—CH3、—CH2—、 和
和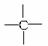 结合而成的。如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含_______个碳原子,其结构简式可能为_______或_______或_______。
结合而成的。如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含_______个碳原子,其结构简式可能为_______或_______或_______。