(15分,除标明外,其余每空2分)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO)
2(t-BuNO)
(1)当(t-BuNO)2的起始浓度(c0)为0.50mol·L-1时,实验测得20℃时的平衡转化率(α)是60%。20℃时上述反应的平衡常数K= 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。已知20℃时该反应在CCl4溶剂中的平衡常数为1.70mol·L-1,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH=+50.5kJ·mol-1,活化能Ea=90.4kJ·mol-1。下列能量关系图合理的是 (填字母)。
(4)该反应的ΔS (填“>”、“<”或“=”)0。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(5)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线
[化学—选修2化学与技术]《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景。人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法。
(1)天然水在净化处理过程中加入明矾做混凝剂,其净水作用的原理是_________(用离子方程式表示)
(2)家庭用水可以用肥皂水检验其硬度,因为 。家用净水器中装有活性炭和阳离子交换树脂(NaR),用过的阳离子交换树脂放入 中可再生。
(3)电渗析法淡化海水的示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
阳极的主要电极反应式是________。在阴极附近加入无色酚酞,看到的现象是___________________________。淡水的出口为________(填“a”“b”或“c”)。
(4)利用海水制得的食盐,制取纯碱的简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①滤出晶体C后,从滤液D中提取氯化铵有两种方法:
方法一、通入氨,冷却、加食盐,过滤;
方法二、不通氨,冷却、加食盐,过滤。
对两种方法的评价正确的是(选填编号)_____________。
a.方法一析出的氯化铵纯度更高 b.方法二析出的氯化铵纯度更高
c.方法一的滤液可直接循环使用 d.方法二的滤液可直接循环使用
②提取的NH4Cl中含有少量Fe2+、SO42―。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。加热至沸的目的是___________。滤渣的主要成分是_______________、____________________。
氮可形成多种氧化物,如NO、NO2、N2O4等。
(1)电解NO制备NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____,理由是:_____________________________。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2‾)和c(CH3COO‾)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4 mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400 mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g) N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
| 时间/s |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0. 08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol/(L.min);n3 n4(填“>”、“<”或“=”),该反应的平衡常数的值为 。
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是 mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为 。
“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是______________。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,可能发生氧化还原
反应,下列反应可能发生的是______________。
A.NH4NO3 → N2 + O2 + H2O B.NH4NO3 → NH3 + HNO3
C.NH4NO3 → O2 + HNO3 + H2O D.NH4NO3→ N2 + HNO3 +H2O
E.NH4NO3→N2+ NH3+ H2O F.NH4NO3 →N2O + H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法。
① H2O2处理法:NaCN + H2O2 —— N2↑+ X + H2O,推测X的化学式为______________。
② NaClO处理法:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,方程式中e : f的值为______________(填选项标号)。
A.1 B.1/2 C.2 D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:
________________________________________________________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。
某溶液A中可能含有NH4+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、SO42-中的几种离子,且溶液中各离子的物质的量浓度均为0.1mol.L-1。现取该溶液进行如下实验: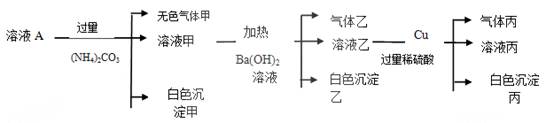
(1)溶液A中一定不存在的离子为____________________________(填离子符号)。
(2)溶液A中加入(NH4)2CO3,生成白色沉淀甲和气体甲的原因是 。
(3)白色沉淀乙的成分为____________________________(填化学式)。
(4)为了进一步确定溶液A中是否含有NH4+,另取10ml该溶液,向其中滴加NaOH溶液,沉淀的物质的量随NaOH溶液体积(mL)的变化如右图所示。据图回答:
①溶液A中______________(填“含有”或“不含有”)NH4+。
②所加NaOH溶液的物质的量浓度为______________mol.L-1 。
③若在A溶液中改加10ml0.2mol.L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______________mol。
运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。
元素R在周期表中的位置是________________________。
元素Y和W形成的Y2W2型化合物中含有化学键的类型为_____________。
测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为______________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
下列能说明碳、硫两种元素非金属性相对强弱的是____________(填序号)
A.相同条件下水溶液的PH:Na2CO3>Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫的危害,其分子结构和CO2相似。
①羰基硫(COS)的电子式为:______________。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:
已知A是一种正盐,则A的化学式为______________;若气体a为单质,反应II的离子方程式为________________________________________________。