(16分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。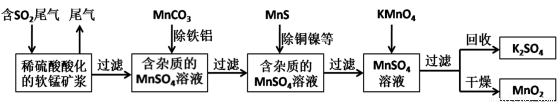
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、 、 ;其中玻璃棒的作用是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是 。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀(此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是 mol/L。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是__________。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 (填操作名称)制得硫酸锰晶体(MnSO4•H2O,相对分子质量为169)。已知废气中SO2浓度为8.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3燃煤尾气,可得到硫酸锰晶体质量为 kg(结果保留3位有效数字)。
我国化学家侯德榜(下图所示)改革国外的纯碱生产工艺,生产流程可简要表示如下: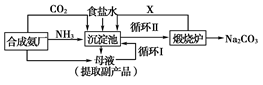

(1)上述生产纯碱的方法称__________________,副产品的一种用途为_______
_。
(2)沉淀池中发生的化学反应方程式是____________________。
(3)写出上述流程中X物质的分子式________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_______________。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用有______。
a.增大NH的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
欲除去下列物质中的少量杂质,请填写所用方法及反应的化学方程式。
| 欲除去的少量杂质 |
方法 |
反应的化学方程式 |
| (1)Na2CO3固体中的NaHCO3 |
||
| (2)NaCl溶液中的Na2CO3 |
||
| (3)NaOH溶液中的Na2CO3 |
某固体混合物可能由KNO3、KI、NaCl、CuCl2中的一种或几种组成,依次进行下列实验,观察到的现象记录如下:①混合物加水得无色透明溶液②将一份溶液滴加氯水并加入CCl4,振荡后静置,CCl4层呈紫色③将另一份溶液加入硝酸银溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
(1)混合物中肯定含有(),但不能判断出是否含有()。
(2)②中反应的离子方程式为。
(3)③中反应的离子方程式为。
某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图为。
画出下列各微粒的结构示意图:
(1)与氖原子电子层结构相同的-2价阴离子:。
(2)最外层电子数为次外层电子数2倍的原子:。 (3)L层电子数为K层、M层电子数之和的原子:。
(3)L层电子数为K层、M层电子数之和的原子:。
(4)与氩原子电子层结构相同的+1价阳离子 :。