(10分)以苯为原料合成高分子化合物I的路线如下:
已知有机物的化学性质主要由官能团决定。请回答下列问题:
(1)含有的官能团名称为______;I的结构简式为____。
(2)写出A→B反应的化学方程式:___________;E+F→G的反应类型为____。
(3)写出H与NaOH溶液在加热条件下反应的化学方程式____。
可降解聚合物P的合成路线如下: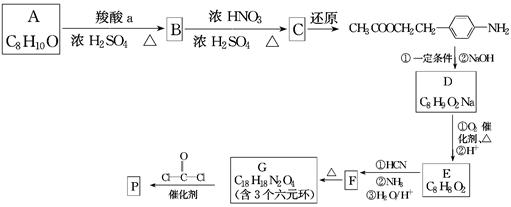
已知:
(R为烃基)
(1)A的含氧官能团名称是________。
(2)羧酸a的电离方程式是_______________________________________________。
(3)B→C的化学方程式是_________________________________________________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是_______________________。
(5)E→F中反应①和②的反应类型分别是________。
(6)F的结构简式是_____________________________________________________。
(7)聚合物P的结构简式是_______________________________________________。
生活中常用的某种香料X的结构简式为
(1)香料X中含氧官能团的名称是________。
(2)香料X可发生的反应类型是________(填代号)。
a.酯化反应 b.还原反应 c.加成反应 d.消去反应
(3)已知: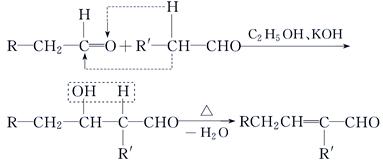
香料X的合成路线如下: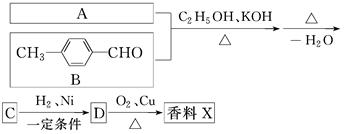
①A的结构简式是________。
②检验有机物C中含有碳碳双键所需用的试剂是________。
a.银氨溶液 b.酸性高锰酸钾溶液 c.溴水 d.氢氧化钠溶液
③D→X的化学方程式为___________________________________________。
④有机物B的某种同分异构体E具有如下性质:
a.与浓溴水反应生成白色沉淀,且1 mol E最多能与4 mol Br2反应
b.红外光谱显示该有机物中存在碳碳双键则E的结构简式为________。
已知: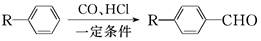
为合成某种液晶材料的中间体M,有人提出如下不同的合成途径: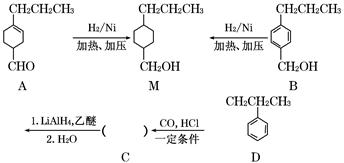
(1)常温下,下列物质能与A发生反应的有________(填序号)。
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是________,由C→B的反应类型为________。
(3)由A催化加氢生成M的过程中,可能有中间生成物 和________(写结构简式)生成
和________(写结构简式)生成
(4)检验B中是否含有C可选用的试剂是________(任写一种名称)。
(5)物质B也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为________。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3
b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:____________________________。
化合物A(C12H16O2)经碱性水解、酸化后得到B和C(C8H8O2)。C中含有苯环,且苯环上有2种氢原子。B经过下列反应后得到G,G由碳、氢、氧三种元素组成,相对分子质量为172,元素分析表明,含碳55.8%,含氢7.0 %,核磁共振氢谱显示只有一个峰。
请回答下列问题:
(1)A的结构简式为_______________,G的分子式为______________。
(2)B的名称为_____________,D中官能团的名称为________________。
(3)写出F→G的化学方程式:________________________________,该反应属于_________(填反应类型)。
(4)写出满足下列条件的C的3种同分异构体的结构简式:___________________。
①是苯的对位二取代化合物;②能与FeCl3溶液发生显色反应;③不考虑烯醇( )结构。
)结构。
(5)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式(写出1种即可):_________________________________________________________________。
下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(T)变化的曲线(已知草酸锰不稳定,但其中锰元素的化合价在300 ℃以下不变)。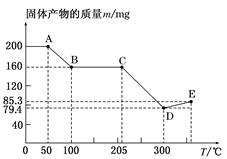
试回答下列问题:
(1)写出B点固体产物的化学式:_________________________________________。
(2)从B点到C点过程中固体物质质量不变的原因是_____________________________________________________。
(3)通过计算确定D点产物的相对分子质量,并推断其合理的化学式:____________
(4)从D点到E点过程中固体物质质量增加的原因是___________________________