某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
(1)装置A中反应的化学方程式是 。
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹。此操作的目的是 。
(3)实验过程装置B中没有明显变化。实验结束取下装置B,从中分别取少量溶液于两支洁净试管中。向第1支试管中滴加适量氨水出现白色沉淀 (填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是 。
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有 性。
(5)装置D的作用是 。
(6)实验后,测定装置D中溶液呈碱性。溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种假设成立。可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 |
实验操作 |
预期现象与结论 |
| 1 |
取少量溶液于试管,滴入几滴酚酞 |
溶液变红 |
| 2 |
|
|
(7)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样。并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验。请计算该空气中SO2的体积分数(用含V的代数式表示) 。
以配制250 mL 1mol /L氢氧化钠溶液为例。实验步骤
①计算:需要NaOH固体质量。
②称量:用托盘天平称取___________gNaOH固体,称量时要注意两个问题:一要装在________里称,二要迅速。
③溶解:用量筒量取蒸馏水注入烧杯里,用玻璃棒搅拌。
④冷却:将溶液冷却至室温。
⑤移液:将冷却溶液用_____引流到____________ 中。在操作过程中不能损失点滴液体,否则会使溶液的浓度偏(高或低)。
⑥洗涤:用适量蒸馏水洗涤烧杯和玻璃棒_____次,并将洗涤液注入容量瓶里。
⑦振荡:手持容量瓶轻轻振荡,使溶液充分混合均匀。
⑧定容:继续加蒸馏水至距刻度线_____处,然后,改用_____滴加蒸馏水正好至刻度线。若加水超过刻度线,会造成溶液浓度偏(高或低),应该。
⑨摇匀:盖好玻璃塞,反复上下颠倒,使溶液均匀。
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: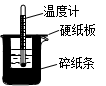
(1)从实验装置看,图中尚缺少的一种玻璃用品是_______________。
(2)烧杯间填满碎纸条的作用是_________________________。
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量__________(填“相等”或“不相等”),中和热__________(填“相等”或“不相等”),理由是__________________________________。
(4)用50mL0.50mol/L的醋酸代替盐酸溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会____________。(填“偏大”、“偏小”或“无影响”)。
(5)完整地做一次这样的实验,需测定______次温度。
(6)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”)
用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题
(1)请写出该实验的实验步骤
①计算,②称量,③,④冷却,⑤移液,⑥洗涤并移液,⑦,⑧ 摇匀。
(2)所需仪器为:500mL容量瓶、托盘天平、玻璃棒、烧杯,还必需一个仪器,该仪器的名称是:。使用容量瓶前必须进行的操作是。用托盘天平称取氯化钠固体的质量是________g
(3)试分析下列操作对所配溶液的浓度有何影响。(填“偏高”或“偏低”或“无影响”)
①容量瓶没有干燥,有少量的蒸馏水:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度:。
③定容是俯视刻度线:。
(1)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的两个错误是:
___________________________________________________;___________________________________________________。
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为___________g.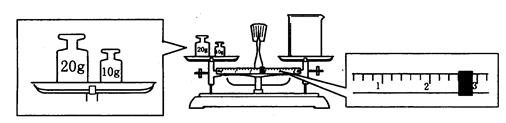
(3)指出下面3个实验中各存在的一个错误:
A__________________________,B__________________________,
C___________________________
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。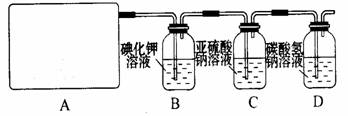
试回答:
(1)该实验中A部分的装置是 (填写装置的序号)。

(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)若D中反应后的溶液具有漂白性,请写出D装置中发生反应的离子方程式 。
(4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:取漂白粉适量,研磨后溶解,配制成漂白液,运用下列实验,检测该漂白液的性质。
①将少量漂白液滴入含有淀粉的KI溶液中,溶液中出现蓝色;
②用pH试纸检测漂白液,试纸边缘为蓝紫色(pH=13),中间部分为白色;
③向漂白液中加入少量稀硫酸,溶液变为黄绿色,产生使湿润的淀粉KI试纸变蓝的气体。
请回答以下问题:
a、实验①表现出该消毒液具有 性;
b、实验②用pH试纸检测消毒液的操作是 _______________________;
c、实验③中涉及反应的离子方程式为 ____________;