焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂。
某研究小组对焦亚硫酸钠进行如下研究:
(1)采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。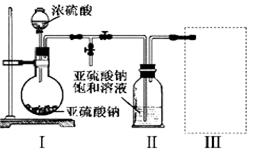
装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:Na2SO3 + SO2 = Na2S2O5。
①装置Ⅰ中产生气体的化学方程式为 。
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。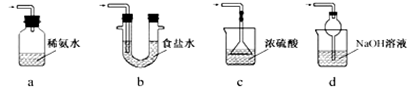
(2)【查阅资料】Na2S2O5溶于水即生成NaHSO3。
①NaHSO3溶液显酸性。请用化学用语和必要的文字解释原因________________________________;
证明该结论可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________。
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72—还原为Cr3+。
①写出该反应的离子方程式_______________________。
②若处理Cr2O72—浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体_________mg。
(12分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
V.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.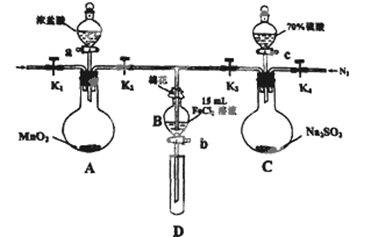
(1)过程Ⅰ的目的是______________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为__________________________________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________
(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作是________________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
| 过程IV B溶液中含有的离子 |
过程VI B溶液中含有的离子 |
|
| 甲 |
有Fe3+无Fe2+ |
有SO42﹣ |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42﹣ |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如下实验流程:
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色氧化铜转化为红色的铜。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得:反应前氧化铜的质量m1 g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。乙小组测得:洗气前装置D的质量m3g、洗气后装置D的质量为m4g、生成氮气在标准状况下的体积V2L。请回答下列问题:
(1)检查A装置气密性的操作是____________________________________________________。
(2)实验室检验氨气的操作和现象是____________________________________。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备制备原理填写在下表的空格中。
| 实验装置 |
实验药品 |
制备原理 |
|
| 甲小组 |
A |
氢氧化钙、硫酸铵 |
反应的化学方程式为____________ |
| 乙小组 |
_____ |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用:_______ |
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为________________。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数之比明显小于理论值,其原因是_______。为此,乙小组在原有实验的基础上增加了一个装有某药晶的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果。该药品的名称是________。
(14分)某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
(1)为快速得到乙醇气体,可采取的方法是;若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是 _________(填写编号);
a.取下小试管 b.移去酒精灯
c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中可能出现的现象为___________________。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。
① M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+;
关于M 中铁元素价态的判断正确的是(填写编号)。
a.一定有+3价和+2价铁,一定无0价铁 b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,一定无+2价铁 d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下:
① 组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是__________(填写编号)
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FeXOY中 =_____。
=_____。
(本题共12分)
我国利用生产磷铵[(NH4)3PO4]排放的废渣磷灰石制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是Ca3(PO4)2,具体生产磷铵流程如下:
38.操作a的名称是___________,实验室中进行此操作的非玻璃仪器用品有___________;在实验室中操作b的名称是______________________。
39.装置a中生成两种酸式盐,它们的化学式分别是_______________________。
40.固体A中一定含有的物质,其化学式是_________________。
41.热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是________________________。
42. 制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是__________。
a.NaOH溶液、酚酞试液 b.KMnO4溶液、稀硫酸
c. 碘水、淀粉溶液 d.氨水、酚酞试液
所用的测量方法为。
(本题共10分)
亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到(NO2与Cl2反应可得硝酰氯)。亚硝酰氯的熔点为-64.5 ℃,沸点为-5.5 ℃,并且遇水蒸气分解为氮的氧化物和氯化氢。
某校化学兴趣小组按如下流程制备亚硝酰氯,实验时,先通入Cl2,待E中U形管内充满黄绿色气体时,再缓缓通入NO。“→”表示气流方向。
34.实验室用氯酸钾和浓盐酸制备Cl2的化学方程式是______________________________。
35.装置F的作用是___________________________________。
36.亚硝酰氯与水反应的化学方程式是________________________________。
37.实验中“先通入Cl2,待E中U形管内充满黄绿色气体时,再将NO缓缓通入”,此操作的目的是______________________________________________________________。