【化学---选修2:化学与技术(15分)】MgSO4·7H2O在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100 g水)
| 温度/ ℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下: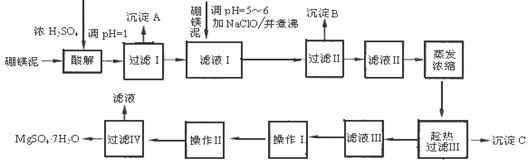
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)沉淀C的化学式是
(2)过滤Ⅲ需趁热过滤的理由是
(3)操作Ⅰ和操作Ⅱ的名称分别为 、
(4)滤液I中加入硼镁泥,调节溶液的pH=5~6,可除去滤液Ⅰ中 (填离子符号);加入NaClO溶液加热煮沸,可将Fe2+氧化成Fe3+的同时,还会将溶液中的Mn2+氧化成MnO2,写出Mn2+被氧化成MnO2的离子反应方程式为
(5)硼镁泥是硼镁矿生产硼砂(Na2B4O7·10H2O)时的废渣。将硼镁矿(Mg2B2O5·H2O)煅烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。此反应为熵减小反应,试写出反应方程式
为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量。
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染。
已知:CH4(g) + 2NO2(g)=N2(g) +CO2(g) + 2H2O(g) △H=-867.0 kJ/mol
NO2(g)= N2O4(g) △H=-28.5 kJ/mol
N2O4(g) △H=-28.5 kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中,发生NO2(g)+SO2(g) SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
(3)如图1是一种用NH3、O2脱除烟气中NO的原理,该原理中NO最终转化为H2O和 (填化学式),当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为 L。
(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。有人利用图2所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95 % 以HCO3-存在),有利于减少环境中温室气体含量。
①a室的电极反应式为 。
②b室中提取CO2的反应的离子方程式为 。
③b室排出的海水(pH<6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海。处理的方法是 。
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其它性质 |
| SO2Cl2 |
-54.1 |
69.1 |
①易水解,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 |
10.4 |
338 |
吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题: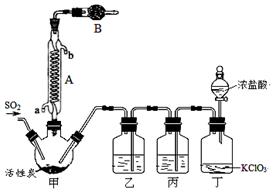
(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。
酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成: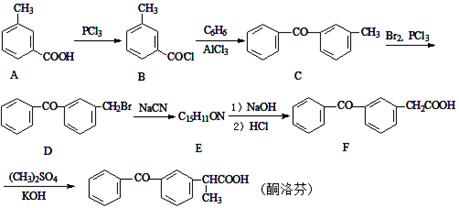
(1)酮洛芬中含氧官能团的名称为 和 。
(2)化合物E的结构简式为 ;由C→D的反应类型是 。
(3)写出B→C的反应方程式 。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式 。
Ⅰ、能发生银镜反应;Ⅱ、与FeCl3发生显色反应;III、分子中含有5种不同化学环境的氢
(5)请写出以甲苯和乙醇为原料制备化合物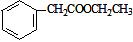 的合成路线流程图(无机试剂可任选)。合成路线流程图示例如图:
的合成路线流程图(无机试剂可任选)。合成路线流程图示例如图: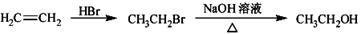
工业上处理含铬(主要成分是HCrO4-)污水并制备磁性铁铬氧体工艺流程如下:
(1)还原过程中HCrO4-转化为Cr3+ 的离子方程式为 ;
(2)当沉淀池中c(Fe2+):c(Fe3+)=2:1时,能生成铁铬氧体。通入压缩空气是形成铁铬氧体的必要条件之一,通入压缩空气的目的是 、 。在加NaOH溶液之前通入的空气量不宜过多,若过多必须向沉淀池中增补的物质可能为: 。(填字母)
| A.FeSO4 | B.Cu | C.H2O2 | D.Fe |
(3)已知三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH 的变化如右图,为尽可能除去铬元素实现清液达标排放,沉淀池中pH要控制在 ;若pH过高,溶液中残留铬量增大,其原因为 。
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)Cu+基态的电子排布式可表示为____________。
(2)1mol甲醛(HCHO)中含有的σ键数目为______________。
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为______________。这两种不同化合物的化学式分别为________________、_______________。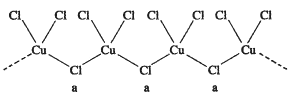
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应生成铜氨离子Cu(NH3)42+,①反应的离子方程式为_________;②[Cu(NH3)4]2+中存在的化学键类型有_______(填序号)。
| A.配位键 | B.离子键 | C.极性共价键 | D.非极性共价键 |
(5)金属铍与氯气也可以形成化合物,在气态二氯化铍中有单体BeCl2和二聚体(BeCl2)2;在晶体中变形成多聚体(BeCl2)n。试画出各种存在形式的结构式,并指出对应Be原子的杂化轨道类型。
结构式_________杂化轨道类型________
结构式_________杂化轨道类型________
结构式_________杂化轨道类型________