计算:
(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是 ,质量之比是 ,密度之比是
(2)下列所给出的几组物质中:含有分子数最多的是 ;含有原子数最多的是 ;标准状况下体积最大的是 。(填序号)
①1gH2; ②2.408×1023个CH4;③10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在标准状况下的体积是 (用含NA的式子表示)。
(4)工业上,向500—600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。

回答下列问题:
①制取无水氯化铁的实验中,装置B中加入的试剂是 。
②制取无水氯化亚铁的实验中若操作不当,制得的FeCl2会含有少量FeCl3,欲制得纯净的FeCl2,在实验操作中应先 ,再 。
(7分)火箭推进器中盛有强还原剂液态胼(N H
H 凰)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 KJ的热量。
凰)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 KJ的热量。
(1)反应的热化学方程式为。
(2)又已知H 0(I)=H
0(I)=H 0(g);△H="+44" kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是KJ。
0(g);△H="+44" kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。
(4)已知N (g)+2O
(g)+2O (g)=2N0
(g)=2N0 (g)△H=+67.7kJ/mol
(g)△H=+67.7kJ/mol
N H
H (g)+0
(g)+0 (
( g)=N
g)=N (g)+2H
(g)+2H 0(g)△H=-534kJ/mol
0(g)△H=-534kJ/mol
则肼与N0 完全反应生成氮气和液态水的热化学方程式为
完全反应生成氮气和液态水的热化学方程式为
(10分)常温下,向100mL0.01mol·L HA溶液中逐滴加入0.02mol
HA溶液中逐滴加入0.02mol MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计)
MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计) 。回答下列问题:
。回答下列问题: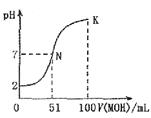
(1)由图中信息可知HA为酸(填“强”或 “弱”),理由是。
(2)常温下一定浓度的MA稀溶液的pH= ,则
,则 7(填“>”、“<”或“=”),用离子方程式表示其原因为,此时,溶液中由水电离出的c(OH
7(填“>”、“<”或“=”),用离子方程式表示其原因为,此时,溶液中由水电离出的c(OH )=。
)=。
(3)请写出K点所对应的溶液中离子浓度的大小关系:。
(4)K点对应的溶液中,c(M )+c(MOH)2c(A
)+c(MOH)2c(A )(填“>”、“<”或“=”);若此时溶液中,pH=lO,则c(MOH)+c(OH
)(填“>”、“<”或“=”);若此时溶液中,pH=lO,则c(MOH)+c(OH )=mol·L
)=mol·L 。(用代数式表示)
。(用代数式表示)
(8分)用:NaCl做原料可以得到多种产品。
(1)工业上由NaCI制备金属钠的化学方程式是。
(2)实验室用惰性电极电解100mL 0.1mol/LNaCl溶液。写出阳极的电极反应方程式:
。
(3)某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl 被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
| A.a为正极,b为负极;NaClO和NaCl |
| B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl |
| D.a为阴极'b为阳极;HClO和NaCl |
假设最后所得溶液中仅含一种溶质,则整个过程用一个化学方程式表示为:
。
(5分)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl 溶液、Fe
溶液、Fe (SO
(SO )
) 溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?(填“能”或“不能”)。若能,请写出电极反应式:负极,正极。若不能,请说明原因。
溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?(填“能”或“不能”)。若能,请写出电极反应式:负极,正极。若不能,请说明原因。
(6分)A、B两种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合,要求A,溶液中的水的电离程度小于A 溶液
溶液 中水的电离程度;B
中水的电离程度;B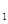 溶液中的水的电离程度小于啦溶液中水的电离程度:
溶液中的水的电离程度小于啦溶液中水的电离程度:
(1)请写出下列各物质的化学式:
A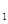 ,A
,A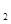 ,B
,B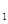 ,B
,B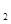 。
。
(2)B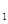 溶液中的水的电离程度小于B
溶液中的水的电离程度小于B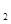 溶液中水的电离程度,其原因是:
溶液中水的电离程度,其原因是:
。