脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下:
(1)写出Ⅳ中含氧官能团的名称 。
(2)写出Ⅳ物质的分子式 。
(3)写出下列反应的类型② ,③ 。
(4)反应②的化学方程式 。
(5)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式 。
(6)下列说法正确的是 。
| A.Ⅰ和Ⅴ均属于芳香烃 |
| B.Ⅱ能发生银镜反应 |
| C.Ⅱ能与4molH2发生加成反应 |
| D.反应③属于酯化反应 |
(7)A的结构简式 。
(8)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式 。
(9)一定条件下,化合物Ⅶ( )也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式 。
)也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式 。
某溶液中可能含有Na+、H+、CO32-、HCO3-、NO3-、SO42-、Cl-、OH-离 子中的几种或全部,①取少量该溶液,加入过量氢氧化钡溶液,产生白色沉淀,该沉淀在盐酸中完全溶解;②另取少量该溶液,加入氯化铵并加热,有剌激性气味的气体X产生,该气体能使湿润的红色石蕊试纸变蓝;③在做②实验后的溶液中,加入硝酸酸化的硝酸银溶液,有白色沉淀产生。
子中的几种或全部,①取少量该溶液,加入过量氢氧化钡溶液,产生白色沉淀,该沉淀在盐酸中完全溶解;②另取少量该溶液,加入氯化铵并加热,有剌激性气味的气体X产生,该气体能使湿润的红色石蕊试纸变蓝;③在做②实验后的溶液中,加入硝酸酸化的硝酸银溶液,有白色沉淀产生。
(1)该溶液中肯定大量存在的离子为;
(2)写出②的离子方程式:。
(3)X与第三周期所有非金属元素的氢化物比较,熔沸点偏高,原因是:。
(4)与X含相同元素的另一简单化合物Y,其所含元素质量比为7:1或者1:7,1gY液态时完全燃烧,生成液态水和另一单质时,放出QkJ的热量,则Y燃烧的热化学方程式为:。
将W g木炭与agO2同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为P0,高温下容器中木炭与O2均完全反应后恢复到原温度,压力表的示数为P(P>P0),试求:
(1)当W取值发生变化时,反应后压强P也发生变化,P的最大值(以P0表示)是______。
(2)以W表示满足题设条件的a的取值范围__________。
(3)在题设条件下,W、a、P、P0之间必须满足函数系W=f(a、P0、P),写出该函数表达式:__________________。
由单质A与化合物B两种粉末组成的混合物, 在一定条件下可按下图所示发生转化:
请回答:
(1)A的化学式;B的俗称;J的化学式
(2)反应③的离子方程式
(3)反应②的离子方程式
(4)沉淀H变沉淀I的化学方程式
(5)如何检验溶液F中的阳离子
将一定质量的Mg,Al合金全部溶解在500mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得下图关系。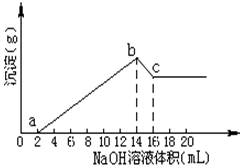
(1)原合金中Mg的质量为g;Al的质量为g
(2)盐酸的物质的量浓度为mol/L
有机物X(C11H9O6Br)分子中有多种官能团,其结构简式为: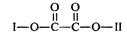 (其中I、II为未知部分的结构),为推测X的分子结构,进行如下图所示的转化过程:
(其中I、II为未知部分的结构),为推测X的分子结构,进行如下图所示的转化过程: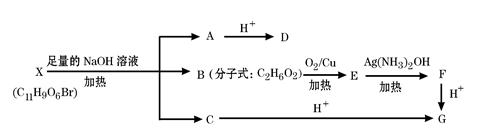
已知向D的水溶液中滴入FeCl3溶液显紫色,滴入NaHCO3溶液有无色无味气体产生,且D苯环上的一氯代物只有两种。
(1)D中除羟基外另 一种含氧官能团的名称是:;X的结构简式为:;
一种含氧官能团的名称是:;X的结构简式为:;
(2)写出B→E的化学方程式:;
(3)D不可能发生的反应有:(填字母标号)
| A.加成反应 | B.消去反应 | C.取代反应 | D.氧化反应 |
(4)D有多种同分异构体,请写出一种同时满足下列三个条件的同分异构体的结构简式:。
①遇FeCl3溶液发生显色反应②能发生银镜反应,③能发生水解反应