甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
反应①:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
(1)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2=-283 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
则反应①的ΔH=________。
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率随反应温度的变化如图所示。
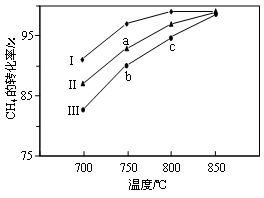
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是________。
②a点所代表的状态________(填“是”或“不是”)平衡状态。
③c点CH4的转化率高于b点,原因是________。
(3)CO和氢气在一定条件下可以合成甲醇,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)。
③在某温度和压强下,将一定量 CO与H2充入密闭容器发生上述反应,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
A.c(H2)减少; B.平衡常数K增大; C.CH3OH 的物质的量增加;
D.正反应速率加快,逆反应速率减慢; E.重新平衡c(H2)/c(CH3OH)减小
(7分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。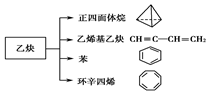
完成下列各题:
(1)正四面体烷的分子式为________,其二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误的是________。
a.能使酸性KMnO4溶液褪色 b.1mol乙烯基乙炔能与3molBr2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例)________、________。
(1) 系统命名法命名: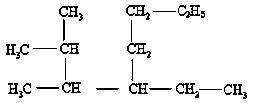
(2)由甲苯为原料,制取烈性炸药(TNT)的化学方程式:
铝铵矾[NH4Al(SO4)2·12H2O]是一种重要的工业原料,将它溶于水配成溶液,然后逐滴滴入NaOH(aq),已知:NH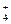 +AlO
+AlO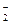 +H2O====Al(OH)3↓+NH3↑,写出先后发生反应的离子方程式:
+H2O====Al(OH)3↓+NH3↑,写出先后发生反应的离子方程式:
(1),
(2),
(3)NH3·H2O NH3↑+H2O,
NH3↑+H2O,
(4)。
现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 |
Ag+ Ba2+Al3+ |
| 阴离子 |
OH- Cl- SO42- |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀是减少,但不消失。
请根据上述实验结果,填空:
⑴写出化合物的化学式:A , C,D, E 。
⑵A溶液与过量E溶液反应后,最终得到的沉淀的化学式是。
现有m g某气体,它由四原子分子构成,它的摩尔质量为M g/mol。则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数为______个。
(3)该气体在标准状况下的体积为______L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为______。
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为______mol/L