金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。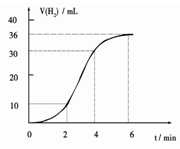
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 |
电极材料 |
电解质溶液 |
电子流动方向 |
| 1 |
Mg Al |
稀盐酸 |
Mg流向Al |
| 2 |
Mg Al |
NaOH溶液 |
|
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水、生成Zn(NH3) 。回答下列问题:
。回答下列问题:
(1)铝的氢氧化物溶于盐酸的离子方程式为。
(2)写出锌和氢氧化钠溶液反应的化学方程式。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是____
①硫酸锌和氨水②硫酸铝和氨水
③硫酸锌和氢氧化钠④硫酸铝和氢氧化钠
(4)写出可溶性铝盐与氨水反应 的离子方程式
的离子方程式 。
。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因。
已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下(部分产物已略去):
(1)工业电解M溶液的化学方程式为。
(2)若A是X、Y同周期的一种常见金属,则A元素在周期表中的位置是,写出A与B溶液反应的化学方程式是。
(3)若A是一种常见酸性氧化物,可用于制造光导纤维,则A元素原子结构示意图为
,写出E与F反应的离子方程式是。
(4)举例说明M物质的一种用途。
按下列要求回答
(1)除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
①Fe(Al)②NH3(H2O)
③NO(NO2)④NaCl溶液(Na2SO4)
(2)实验室配制100mL0.5mol·L‑1的Na2CO3溶液,回答下列问题:
①应用托盘天平称取碳酸钠粉末g。
②配制时应选用的仪器有500mL溶量瓶,托盘天平、烧杯、药匙、。
③若实验时遇到下列情况,所配溶液的浓度偏大的是。
| A.加水定容时超过刻度线,又吸出少量至刻度线 |
| B.没有将洗涤液转入容量瓶 |
C.容量瓶洗涤后内壁有水珠而未作干燥 处理 处理 |
| D.定容时府视刻度线 |
已知稀溴水和氯化铁溶液都呈黄色。现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉—碘化钾溶液。请完成以下实验探究过程:
【提出假设】
假设1:溶液呈黄色不是发生化学反应所致,是溶液中引起的(填微粒的化学
式,下同)。
假设2:溶液呈黄色是发生化学反应所 致,是溶液中引起的。
致,是溶液中引起的。
【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
假设1方案:。
假设2方案: 。
。
(2)根据高中所学的知识判断,你认为(填“假设1”或“假设2”)的推断是正确的;若选用淀粉—碘化钾溶液验证你的假设是否可行?(填“可行”或“不可行”),理由是。
(3)若向 稀溴化亚铁溶液中通入过量
稀溴化亚铁溶液中通入过量 氯气,反应的离子方程式为。
氯气,反应的离子方程式为。
|
某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
实验一、如图Ⅰ~Ⅳ所示。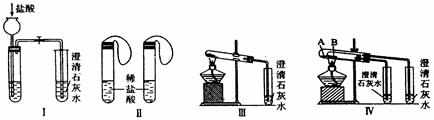

 ;
;