化学反应中,有时存在物质的量多少不同,反应不同(或物质的浓度或反应温度、催化剂等反应条件不同,反应产物不同)的特殊情况。下列反应中,属于这种情况的是
①锌与18 mol/L的硫酸反应; ②浓盐酸与过量的MnO2反应;
③CuSO4溶液与氨水; ④过量铜与浓硝酸反应;
⑤Ca(OH)2溶液与NaHCO3溶液混合; ⑥乙醇与氧气在一定条件下反应;
⑦甲酸与新制Cu(OH)2悬浊液; ⑧苯与液溴在一定条件下发生反应
| A.除②外 | B.②③⑤ | C.①④⑤ | D.①②③④⑤⑥ |
下列叙述中,不能用平衡移动原理解释的是()
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)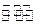 2C(气),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(气),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A的转化率为70%
④ 2 s 时物质 B的浓度为 0.7 mol·L-1
其中正确的是()
| A.①③ | B.①④ | C.②③ | D.③④ |
将 1molSO2和1molO2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,SO3为0.3mol。若此时移走0.5molO2和0.5molSO2,则重新达到平衡后,SO3的物质的量为()
| A.0.3mol | B.0.15mol |
| C.小于0.15mol | D.大于0.15mol,小于0.3mol |
完全相同的两个容器甲和乙,已知甲中装有SO2、O2各1克,乙中装有SO2 O2各2克,在同一温度下反应,2SO2(g)+O2(g) 2SO3(g)达平衡时,甲中SO2的转化率为a% ,乙中SO2的转化率为b%,则()
| A.a% > b% | B.a%< b% | C.a%=" b%" | D.无法判定 |
反应mA(固)+nB(气)pC(气)+Q在一定温度下B的体积分数(B%)与压强变化的关系如图2-11所示,下列叙述中正确的是()
 ①m+n>P;②x点表示该反应的正反应速率大于逆反应速率;③n>p;④x点比y点时的反应速率慢。
①m+n>P;②x点表示该反应的正反应速率大于逆反应速率;③n>p;④x点比y点时的反应速率慢。
| A.只有① |
| B.只有②④ |
| C.只有①②④ |
| D.只有①和③ |