【化学—选修3物质结构与性质】前四周期原子序数依次增大的六种元素M、A、B、C、D、E中,M、A的最高化合物与最低化合价的绝对值相等,A形成的化合物种类最多,A、B属于同一短周期元素且相邻, C、D、E是位于同一周期的金属元素,基态C原子的价电子层中未成对电子为1个,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),其原子结构示意图是______。
(2)M与B元素形成的化合物空间构型是_____,在实验室制取该物质的方法是 (用化学反应方程式表示),收集方法是_______;
(3)E的价层电子排布图为 ,未成对的电子数是______;很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO。
、④HCHO。
其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
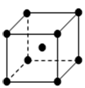
(4)金属C晶体的晶胞结构如图。C晶体晶胞中金属原子的配位数之比为 。在一个晶胞中含有C原子是_____个。氧化镍(NiO )是一种纳米材料,比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm列式表示其比表面积 m2/g。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。

(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
①A电极对应的金属是________(写元素名称),B电极的电极反应式是________________________。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
____________________________________________________
将1 L含有0.4 mol CuSO4和0.2 mol NaCl 的水溶液用惰性电极电解一段时间后。
(1)若在一个电极上得到0.1 mol Cu,另一电极上析出气体(在标准状况下)的体积是________ L。
(2)若在一个电极上恰好得到0.4 mol Cu,另一电极上再析出气体(在标准状况下)的体积是________ L。
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
(1)写出反应①的化学方程式:。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为。
(2)净化步骤所得滤饼的主要成分是。回收的洗涤液代替水配制电解液,目的是回收利用其中的。
(3)溶液Ⅰ的主要成分是。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是。
(4)将Co2O3还原成Co粉的化学反应方程式为。
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;
请回答下列问题:
(1)固体a的化学式为,Ⅲ中通入足量CO2气体发生反应的离子方程式为。
(2)由Ⅴ制取铵明矾溶液的化学方程式为,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为。