某研究性学习小组,利用固体Na2SO3与中等浓度的H2SO4反应,制备SO2气体并进行有关性质探究实验。该反应的化学方程式为:Na2SO3(固)+H2SO4=Na2SO4 + SO2↑+H2O。除固体Na2SO3和中等浓度的H2SO4外,可供选择的试剂还有:
①溴水 ②浓H2SO4 ③品红试液 ④紫色石蕊试液 ⑤澄清石灰水 ⑥NaOH溶液
回答下列问题:
(1)欲验证SO2的漂白作用,应将SO2气体通入 中(填物质编号),观察到的现象是 ;
(2)欲验证SO2的还原性,应将SO2气体通入 中(填物质编号),观察到的现象是 ;
(3)为说明SO2的氧化性,通常利用的反应是 (写化学反应方程式);
(4)为防止多余的SO2气体污染环境,应将尾气通入 中(填物质编号),
反应离子方程式为 ;
(5)有一实验小组发现,SO2产生缓慢(不考虑SO2在溶液中的溶解,实验中也不存在漏气、反应温度等装置和操作上的问题),请你推测可能的原因(至少填写一种):
① ,② 。
(6分) 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: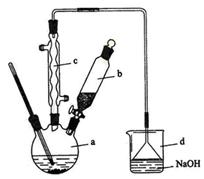
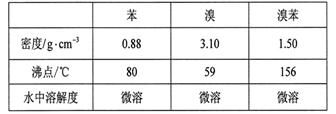
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了__________气体。继续滴加至液溴滴完。装置d的作用是____________________________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0 mL水、8 mL l0%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是除去HBr和未反应的Br2;③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);
A重结晶 B过滤 C蒸馏 D萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。
A 25 mL B 50 mL C 250 mL D 509 mL
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器除F外还有(填代号,限填2项)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:Iˉ溶液的获取。操作是。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用(填代号)____________。
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
理由是
(4)第4步:碘单质的检验。取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
实验室采用不同的实验装置研究苯与液溴的反应类型并制取少量溴苯。试回答下列各小题:Ⅰ.若用图甲装置进行进行制备实验,回答下列问题: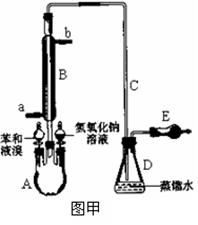
(1)写出下列仪器的名称:A、B。
(2)A中预先需加入的试剂是,E中需加入的试剂是。
(3)仪器B除导气外的作用是,进水口为(选填字母“a”或“b”)。
Ⅱ.若用图乙装置进行制备实验,回答下列问题: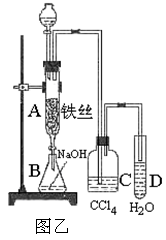
(1)C中盛放CCl4的作用是;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,写出有关的离子方程式 ,然后用仪器分离出溴苯(仍含有少量苯);
(3)反应完毕后,向试管D中滴加AgNO3溶液有 (填现象)生成,此现象说明这种获得溴苯的反应属于(填有机反应类型)。
实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题: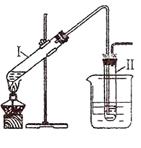
(Ⅰ)用右图所示的装置制取溴乙烷:
在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入冰水。加热试管I至微沸状态数分钟后,冷却。
(1)试管I中生成溴乙烷的化学反应方程式为:。
(2) 试管I中加入2 mL 的蒸馏水,其作用除溶解NaBr粉末和吸收HBr气体之外还有一个重要作用是_____。
(3)反应结束后,试管Ⅱ中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的 __________(填字母)
| A.NaOH溶液 | B.H2O | C.Na2SO3溶液 | D.CCl4 |
(4)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后____________________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
(Ⅱ)溴乙烷的性质实验
(5)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过右图所示的装置。用该装置进行实验的目的是检验乙烯的生成,该图中右边试管中的现象是;左边试管中水的作用是。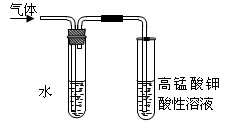
下列是模拟石油深加工来合成CH2=CHCOOCH2CH3(丙烯酸乙酯) 等物质的过程: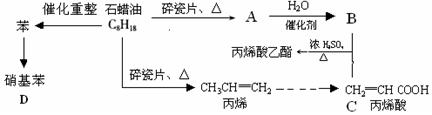
请回答下列问题:
(1)A结构简式为: ,
(2)CH2=CHCOOCH2CH3的含氧官能团(填名称);
(3)写出下列反应方程式:
B+C→CH2=CHCOOCH2CH3:,
丙烯→聚丙烯:,
苯→硝基苯:,
(4)目前制备酒精的方法有两种:
方法一: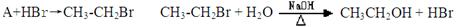
方法二: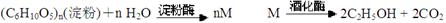
①对方法一所涉及的反应类型分别为: 、
②对于方法二, M的结构简式为:
③下列说法正确的是____________(填代号)
A、从绿色化学的角度看方法一的原子利用率100%
B、从原料的可再生性来说,方法二最好
C、方法二产物乙醇储藏的化学能来自于太阳能