氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
(1)断开N2分子内的共价键要 热量(填“吸收”或“放出”)
(2)分析反应②对①、③平衡移动的影响 。
(3)Al2O3、C、N2合成AlN的平衡常数表达式K= 。
(4)用蒸馏法测定产品中AlN的含量,装置如下(加热及夹持装置略):
①AlN与NaOH溶液反应产生NH3的化学方程式是 。
②锥形瓶内吸收NH3的离子方程式是 。
③检验NH3是否完全蒸出的方法是:另取少量蒸馏出的溶液, (将检验过程补充完整)。
④NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c((N aOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为 。下面有关计算正确的是 。
。下面有关计算正确的是 。
A.样品中AlN的质量:
B.AlN的质量分数:
C.锥形瓶吸收NH3的物质的量:
化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3+H2O 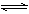 NH3·H2O
NH3·H2O 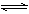 NH
NH +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向______移动,OH-的浓度_____,NH4+的浓度_______。
(2)向氨水中加入浓盐酸,平衡向______移动;
(3)向浓氨水中加入少量NaOH固体,平衡向_____移动,此时发生的现象是__________。
将含有Ag+、Mg2+、Al3+、Na+等离子的稀溶液,按下列实验步骤进行离子的依次分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)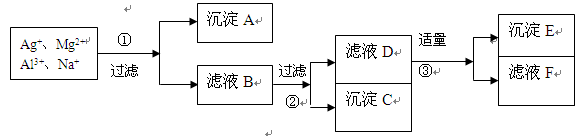
(1)沉淀A是 ___,沉淀C ___,沉淀E是;
(2)加入试剂①是 ____,②是________________,③是______________。
某种常见的白色晶体A,与盐酸反应产生无刺激性气味的气体B,将B通入澄清石灰水,石灰水变浑浊。若在A的水溶液中加氢氧化钡溶液微热,则析出白色沉淀C和无色气体D,D可以使湿润的红色石蕊试纸变蓝。加热固体A,可生成水、B和D,而且B和D的物质的量之比为1:1.根据以上事实,可以判断出A是,B是,C是。
加热固体A生成水、B和D的化学方程式是_____________,
A与盐酸反应的离子方程式___________________________________,
A与氢氧化钡溶液反应的离子方程式_______________________________________________。
如右图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由_______________逐渐变为_______色,试管内的液面会逐渐_____________,剩余气体约占试管容积的__________,用化学方程式表示这种变化__________________________;上述反应停止后向试管中缓慢通入氧气,气体颜色又由______色逐渐变为____________色,之后又变为______色,继续通入氧气,直到试管中充满液体为止,用一个化学方程式表示试管中发生的化学反应_____________________________________。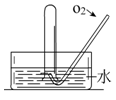
我国使用最早的合金是_____________,目前用量最大,使用最广泛的合金是___________。合金的硬度一般比它的各成分金属的硬度_________,多数合金的熔点一般比它的各成分金属的熔点___________。镁铝合金投入氢氧化钠溶液中,反应的化学方程式为__________________________,红热的铁片投入水中,表面生成一层黑色晶体,反应的化学方程式为___________________________。