(12分)在右图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g。请回答下列问题: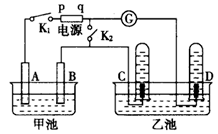
(1)电解过程中,乙池C电极发生反应的电极反应式 。
(2)甲池电解时反应的离子方程式 。
(3)甲池电解后溶液的pH= ,要使电解后溶液恢复到电解前的状态,则需加入 ,
其质量为 g。(假设电解前后溶液的体积不变)
(4)电解后若再将K1断开,闭合K2,电流计指针发生偏转,则D电极发生反应的电极反应式 。
(13分)(1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式
(2)工业上制取漂白粉的化学方程式为____________________。
(3)在标准状况下,33.6 L氯气的质量是________g,将红热的铁丝与其完全反应,反应的化学方程式为,最多可消耗铁的物质的量为mol。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
⑴工业上一般采用下列反应合 成甲醇:CO(g)+2H2(g)
成甲醇:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
①下列数据是在不同温度下的化学平衡常数(K)。
| 250℃: K1=__________ |
300℃: K2=0.270 |
350℃: K3=0.012 |
由表中数据判断ΔH0(填“>”、“=”或“<”=。)
②250℃,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得:
CO剩余0.4mol,求K1。
⑵已知在常温常压下:①CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-442.8KJ/mol
②2CO(g)+O2(g)=2CO2(g);ΔH2 =-566.0kJ/mol
写出甲醇燃烧热的热化学方程式____________________________________________,
⑶某实验小组依据甲醇燃烧的反应原理,设计如图(A)所示的燃料电池装置。则:
①该燃料电池负极的电极反应为:___________________________ ,
,
②用该甲醇燃料电池对B池进行电解,己知c、d是质量相同的铜棒,电解2min后,取出c、d,洗净、烘干、称量,质量差为0.64g,在通电过程中,电路中通过的电子为_________mol。
某研究性学习小组将下列装置如图连接,a、b、c、d、g 、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。
、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。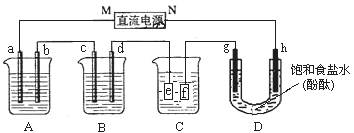
试回答下列问题:
(1)电源M极的名称是______。
(2)通电一段时间,取出电极,向A中加入4.9gCu(OH)2,溶液与电解前相同,则电解时电路中通过的电子为_________mol,原CuSO4溶液物质的量浓度为________mol•L-1;
(3)B中d的电极反应式为________________________________________________,
d极上产生的气体体积为____________L(标况)
(4)欲用C装置给铜镀银,f是__________(填银或铜),电镀液是__________溶液。
(5)电解后将D中溶液倒入烧杯,稀释至200ml,此时溶液的PH=_______。
铝和氢氧化钠都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 ________________。
(2)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如左下图所示。
①请写出A、B两处物质的名称:A___________________、 B____________________
B____________________
②请写出电解食盐水的离子方程式__________________________________________
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如上中图。
①负极材料为________(填Mg或Al)。
②该原电池的总反应式为____________________________________________
(要求用单线桥标出电子转移的方向和数目)
(4)铝—空气燃料电池可用于电动汽车,通常以NaOH溶液为电解液,铝合金为负极,通入空气的极为正极(如右上图),则
负极的电极反应式为 ______________________;
正极的电极反应式为_______________ ____________________。
____________________。
汽车的启动电源常用铅蓄电池,电池反应为:Pb+PbO2+4H++2SO2-4 2PbSO4+2H2O;据此判断:
2PbSO4+2H2O;据此判断:
(1)放电时,铅蓄电池的负极材料是________;电极反应为__________________________
(2)放电时,电解质溶液中阴离子移向________极。
(3)若用该铅蓄电池作电源电解足量的食盐水,阳极产生0.05molCl2时,理论上H2SO4的
物质的量减小_______mol。
(4)铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。
关于标有“—”的接线柱,下列说法中正确的是___________
A.充电时作阳极,放电时作负极 |
B.充电时作阳极,放电时作正极 |
C.充电时作阴极,放电时作负极 |
D.充电时作阴极,放电时作正极 |
(5)充电时的阳极反应式是____________________________________。