利用零价铁(ZVI)处理水体砷污染的原理为:零价铁被氧化腐蚀得到水合氧化铁,[Fe(OH)3和 FeOOH,可分别写为Fe2O3•3H2O和Fe2O3•H2O统称水和氧化铁],水合氧化铁再吸附沉降砷的化合物(如:含AsO43 -、AsO33 -等物质)。
(1)写出单质铁在水体中被(O2)氧化腐蚀得到水和氧化铁(FeOOH)的化学方程式: 。
(2)某课题组通过查阅文献,进行了用相同单质铁(相同性状和相同质量)在相同时间内,对影响零价铁去除水体中砷的效率的因素提出以下假设,并进行了实验探究:
假设1: ;
假设2:水体中所含其他物质及离子;
假设3:水体中的溶解氧;
(3)其他条件相同,调节水样的pH,得到除砷效率曲线为图1,若控制水样pH=5时,测定不同时间段的除砷效率为图2: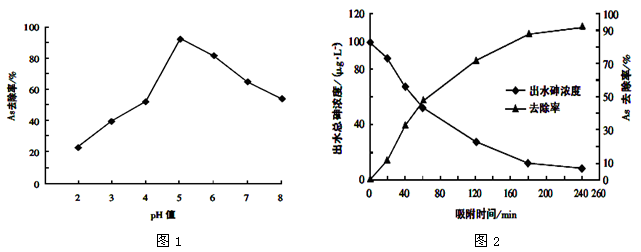
①根据单质铁除砷原理,请解释水样酸性较强时,除砷效率较低的原因可能是_____________;
②国家饮用水标准规定水中砷的含量应低于0.05mg/L(1mg=1000μg),根据图中信息判断:若控制水样的pH=6,出水后的砷浓度是否达到饮用水标准?_______。(填“达到”、“未达到”或“无法判断”)
(4)为验证假设3,课题组成员设计了以下实验。请你完成表格中的内容(水样中砷的浓度可用分光光度计测定)
| 实验步骤 |
预期实验结果和结论 |
| ①取一定体积废水样品,分成体积相同两份,其中一份持续通入一段时间_________,以减少水中的溶解氧; |
___________________,则溶解氧对砷的去除效率有影响;反之则无影响。 |
| ②___________________________________ ______________________________________ |
|
| ③___________________________________ ______________________________________ |
根据所学知识填空。
(1)写出此分子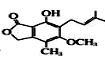 含有的官能团名称 。
含有的官能团名称 。
(2)写出铝热反应的化学方程式 。
(3)用离子方程式表示泡沫灭火器的灭火原理 。
(4)根据沉淀溶解平衡原理,用离子方程式解释碳酸钙溶于盐酸的过程 。
(5)写出有机物名称为 2,5 -二甲基-4-乙基庚烷的结构简式 。
(6)常温下,将pH=5的盐酸和pH=9的NaOH溶液以一定的体积比混合后,所得溶液的pH=6,则盐酸和氢氧化钠溶液的体积比是 。
(7)下列8组物质,互为同分异构体的是 组。
①甲烷和十七烷 ②金刚石和石墨③O2和O3④甲苯和苯乙烯
⑤邻二甲苯和间二甲苯 ⑥12C 和14C ⑦ 和
和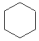 ⑧2-丁炔和1,3-丁二烯
⑧2-丁炔和1,3-丁二烯
将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如右图所示。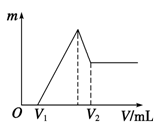
当V1=140 mL时,则金属粉末中:n(Mg) =________ mol,V2=______ ml。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a ,用100 mL 2 mol·L-1的H2SO4,再加入480 mL 1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是_________。
(1)KClO3与浓盐酸发生反应:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O,该反应中被氧化的元素和被还原的元素的质量之比为__________。转移1 mol电子时,产生标准状况下的Cl2__________ L。
(2)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应: NaClO2+HCl→ClO2↑+NaCl+H2O
写出配平的化学方程式________________。生成0.2 mol ClO2转移电子的物质的量为________ mol。
(3)取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为__________________。如果向FeBr2溶液中通入等物质的量的Cl2,该反应的离子方程式为___________________________。
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、 Ag+、 Mg2+、 Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出0.56L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
(4)判断K+是否存在 ,(填“是”或“否”),若存在求其最小浓度,若不存在说明理由 。
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的一些问题:
(1)上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)
| A.Na2O2+2HCl=2NaCl+H2O2 |
| B.Ag2O+H2O2=2Ag+O2↑+H2O |
| C.2H2O2=2H2O+O2↑ |
| D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O |
(2)保存过氧化氢试剂瓶上的最适合贴上的一个标签是 (填字母代号)。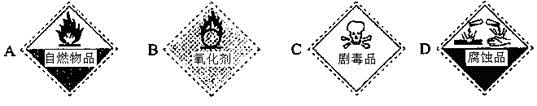
(3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①写出该反应的离子方程式并配平_______________________________。
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子数目为 。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是 。