过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的一些问题:
(1)上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)
| A.Na2O2+2HCl=2NaCl+H2O2 |
| B.Ag2O+H2O2=2Ag+O2↑+H2O |
| C.2H2O2=2H2O+O2↑ |
| D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O |
(2)保存过氧化氢试剂瓶上的最适合贴上的一个标签是 (填字母代号)。
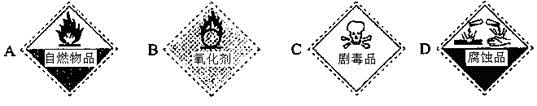
(3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①写出该反应的离子方程式并配平_______________________________。
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子数目为 。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是 。
某班学生对BeCl2是离子化合物还是共价化合物进行集体探究,从经验看铍是金属元素,易失去电子,氯元素易得到电子,请回答以下问题:
(1)Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为 化合物。
(2)工业上制取BeCl2方法是:将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式 。
(3)经实验验证,熔融的BeCl2不能导电,说明它是 化合物;BeCl2能溶于水,水溶液能导电,因它在溶液中能电离,写出它的电离方程式 。
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,判断BeCl2应与 (填MgCl2或AlCl3)化学性质更相似。
(5)0.1mol氢氧化铍恰好能和100mL0.2mol/L的氢氧化钠溶液发生反应,写出反应的化学方程式 。
下表是元素周期表的一部分,表中列出了8种元素在周期表中的位置。请回答有关问题。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
⑤ |
⑥ |
⑦ |
||||
| 3 |
② |
④ |
|||||
| 4 |
① |
③ |
⑧ |
(1)写出元素⑧的基态原子核外电子排布式 ;
(2)元素⑤⑥⑦第一电离能由大到小的顺序是 (用电离能和元素符号表示);
(3)元素①、②、③对应的氧化物熔点由高到低的顺序排列是 (填化学式);
(4)元素③、②、④形成的单质晶体的熔点升高的原因是 。
下图是病人输液用的葡萄糖(分子式为C6H12O6,相对分子质量为180)注射液的标签上的部分内容。
(1)该注射液中葡萄糖的质量分数是 。
(2)该注射液中葡萄糖的物质的量浓度是 (小数点后保留两位)。
(3)实验室配制250 mL该浓度的葡萄糖溶液需要用天平称取葡萄糖粉末 g ,需要的主要玻璃仪器有量筒、烧杯、胶头滴管、 、 等。
(4)下列操作不正确的是 (填序号)。
①使用容量瓶前检查它是否漏水
②定容时仰视刻度线
③定容时加水超过刻度线,把水倒出一些,重新加水至刻度线
④定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤
称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. 试通过计算填空:
(1)A的相对分子质量为: .
(2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g,则A的分子式为: .
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况) 则A中官能团的结构简式: 、 .
(4)A的核磁共振氢谱如图:
则A中含有 种氢原子
(5)综上所述,A的结构简式 .A与浓H2SO4混合,在一定条件下反应生成六元环状物B,B的结构简式 .
根据下面的合成路线及所给信息填空:
(1)A的结构简式是________________,名称是___________________
(2)①的反应类型是___________________,③的反应类型是___________________
(3)反应④的化学方程式是___________________.