粗盐中含有泥沙等难溶性杂质和氯化镁、氯化钙等可溶性杂质,某学习小组做粗盐的提纯实验。
【提出问题】如何才能将粗盐中的杂质除去,获得精盐?
【实验方案】该小组按以下流程进行实验。
【问题讨论】
(1)实验步骤②③④都需要进行 操作,该操作中玻璃棒的作用是 。
(2)沉淀X是 ,沉淀Y是 。
(3)有同学认为该实验方案不完善,请你说明原因并补充完善: 。
(4)将实验所得的精盐在烧杯中配制成100g 8﹪的氯化钠溶液。经检测,所配溶液溶质质量分数偏小,其可能原因有 (填序号)。
①精盐称量时,仅在左盘垫上了称量纸,而右盘没有垫上称量纸;
②溶解时所用烧杯不干燥;
③所得精盐未完全干燥。
(5)工业上用电解饱和食盐水的方法可制取氢氧化钠,同时还生成两种气体单质。写出此反应的化学方程式 。
蕲春实验中学化学课外活动小组选择如下相应的装置对某有机物燃烧产物进行探究,并对该有机物成分进行测定: A B C D E
A B C D E
[提出假设]根据质量守恒定律,可得出该有机物燃烧产物可能为①CO2、H2O;②H2O、CO;③CO2、H2O、CO。
[设计实验]
(1)余成林同学选择D、E分别验证假设①,如观察到E中现象,则证明有H2O,如观察到D中现象,则证明有CO2;
(2)翁京京同学选择装置A、C、D、E按照E D C A 的连接顺序一次性来验证假设②,实验时发现E中无水CuSO4变蓝,D中澄清石灰水变浑浊,A中黑色CuO变成光亮红色,则假设②是否成立,得出这个结论的理由是:。
(3)汪俊同学同样按照E D C A D的连接顺序来验证假设③,如该假设成立,则丙同学应应观察到____________________________________________现象,那么该实验装置还有何不足: _______________ 。
(4)现假设该有机物燃烧产物为CO2、H2O,有甲、乙两组同学选择B、C装置分别两种方法测定它的组成,得出两组数据(连接顺序与数据如下表)
| 有机物 的质量 |
装置的连接顺序 |
 装置的质量 装置的质量 实验前实验后 实验前实验后 |
|
| 甲组 |
1.6克 |
C接B |
B 200克 B 202.3克 C 200克 C 201.7克 |
| 乙组 |
1.6克 |
B接C |
B 200克 B 201.8克 C 200克 C 202.2克 |
你认为甲、乙两小组的两种方法哪种正确?,理由是: _____。请你选择、计算得出有机物各元素的质量比:。
某学校“我与化学”学习小组发现,铜绿 [Cu2 (OH)2CO3] 受热分解后,除生成CO2和水蒸气外,试管中还有一些黑色粉末状固体。于是他们就通过实验探究分析黑色固体的组成,并验证产生的气体。请你参与一起分析探讨:
(1) 试管中的黑色团体可能是炭粉,也可能是氧化铜,还可能是。
(2) 经查阅资料可知炭粉不能与酸反应,也不溶于酸,而氧化铜则可与酸反应而溶解。于是他们先向试管中的黑色固体里加入一种溶液来检验黑色固体究竟是什么?你认为他们可加的溶液是(填化学式)
(3) 具体分析如下:假如黑色固体是炭粉,应该看到的现象是;如果发现,该黑色固体则是氧化铜;假如现象为,才证明第三种可能成立。
(4) 若用右图装置验证两种气体生成物,
应将生成的混合气体先通过(填“A”或“B’’”)装置,不然就会有影响,原因是。当将气体通入装置A进行验证时,气流应从通入。
实验室有两瓶失去标签的试剂,其中一瓶是固体,另一瓶是液体。化学学习小组分别各取少量这两种试剂在试管中混合,发现立即产生一种无色气体。老师要求他们探究这两种试剂反应产生的气体究竟是什么?验证实验方案如下:
试根据你的猜想写出产生此气体的化学方程式。
如果要求你制取该气体,采用的发生装置可选取下图中的(填序号).
AB CDE
有同学提出此无色气体还有可能是另外一种气体,也请写出这种气体_______(填化学式)
做"镁带在空气中燃烧"实验时,小科同学发现生成物中有少量黑色固体.黑色固体是镁和什么物质反应所产生的?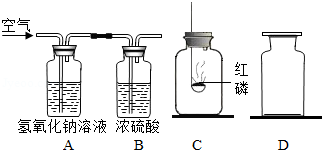
他提出下列猜想:
猜想一:黑色固体可能是镁和氮气反应的产物;
猜想二:黑色固体可能是镁和二氧化碳反应的产物.
为了验证上述两个猜想,小科设想:
(1)让空气通过
、
装置,其中A装置的作用是 ;
(2)用
瓶收集通过
、
装置后的气体,并加入足量的红磷燃烧;待
瓶冷却后,再把点燃的镁带放入
瓶中.
经过思考发现,由于收集气体时相关气体的密度差异及C瓶冷却后瓶内外的气压差异,达不到预期效果.
于是,他在老师的帮助下获得了这种气体,观察到镁带在该气体中燃烧并有淡黄色的固体产生;然后用
瓶收集一瓶气体,把点燃的镁带放入
瓶中,观察到镁带在
瓶也能燃烧,同时有白色和黑色固体生成.
通过以上实验,得出结论:猜想正确.同时,他对燃烧有了新的认识:
为检测某化工厂排放的废液中是否含有
,同学们设计了如下方案,并进行了实验.
| 方案 |
步骤 |
现象 |
结论 |
| Ⅰ |
①取样品.滴加
溶液 ②对步骤①反应后的混合物进行过滤,在滤渣中滴加稀盐酸 |
①有白色沉淀产生 ②无明显现象 |
废液中含有
|
| Ⅱ |
①取样品,滴加过量②在步骤①的溶液中滴加
溶液 |
①无明显现象 ②有白色沉淀产生 |
废液中含有
|
| Ⅲ |
①取样品,滴加
溶液 ②对步骤①产生的混合物进行过滤,在滤渣中滴加稀硝酸 |
①有白色沉淀产生 ②无明显现象 |
废液中含有
|
(1)方案Ⅱ的实验结论如果正确,步骤①中滴加的物质是.
(2)方案Ⅰ和Ⅲ中,结论不成立的方案是,理由是.
(3)方案Ⅲ的滤渣中,滴加稀硝酸是为了排除的干扰.