同学们对
是否支持常见金属的燃烧进行了如下探究活动:
【活动一】探究
是否支持实验室常见金属镁的燃烧
实验①:将燃着的镁条插入充满
的集气瓶中,发现镁条仍在燃烧.观察生成物,除白色物质外,还有黑色物质.
(1)镁在
中反应的化学方程式为.
(2)实验①的结论是,由该结论可知(写"能"或"不能")用
灭火器扑灭活泼金属的火灾.
(3)通过实验①你对燃烧条件的新认识是.
【活动二】探究
是否支持生活中常见金属铁的燃烧
实验②:将弯成螺旋状的细铁丝系上一支火柴,点燃火柴后立即将铁丝插入装有
的集气瓶中,发现铁丝未燃烧.
某同学提出:如果实验②中细铁丝未得到充分加热,将对判断"
是否支持铁的燃烧"造成干扰.他依据什么认为实验②中细铁丝未得到充分加热
请你帮助他设计对比实验,排除干扰因素,证明
是否支持铁的燃烧.
| 实 验 方 法 |
可能观察到的现象和结论 |
| 如果铁丝在装
和装
的集气瓶中都燃烧,证明
支持铁的燃烧 |
|
| 如果铁丝在装
的集气瓶中燃烧,在装
的集气瓶中逐渐冷却,证明
不支持铁的燃烧 |
实验室选用下列装置制取气体。根据要求回答问题: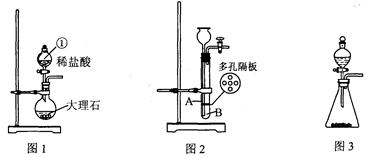
(1)图1中仪器①的名称,该装置中发生的化学方程式为。
(2)用图2装置也可以制取二氧化碳气体,实验前检查该装置气密性的方法是。其中块状固体应放置在处(填“A”或“B”)。利用图2装置反应一段时间后,需停止反应,其操作是。
(3)用图3装置制取氧气,反应结束后冷却,对制取氧气后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰。正确操作的先后顺序是(填写序号)。
A.烘干B.溶解C.过滤D.洗涤
②过滤、蒸发时都需用到的仪器是(填序号)。
A.酒精灯B.烧杯C.玻璃棒 D.漏斗
(4)若用装置图3制取气体过程中反应剧烈,从实验安全角度考虑,可采取的措施有(填序号)。
①用容积较小的锥形瓶②控制液体的滴加速度
③加热反应物④降低反应物浓度
小雨为学校化学兴趣小组的同学,阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣.
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列三组实验
| 实验序号 |
KClO3质量 |
其他物质质量 |
待测数据 |
| ① |
1.2g |
0 |
|
| ② |
1.2g |
CuO 0.5g |
|
| ③ |
1.2g |
MnO2 0.5g |
①上述实验应测量的“待测数据”是.
②若实验②比实验①的“待测数据”更(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率.
③将实验②反应后的固体经提纯分离仍得到0.5克黑色粉末,再将黑色粉末放入试管中,
(简述操作和现象),说明氧化铜还能作氯酸钾的催化剂.
【评价设计】你认为小雨设计实验③和实验②对比的目的是
.
某同学用相同的铁钉探究铁生锈与哪些因素有关,设计的实验如图。
经过一周观察:试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀。
(1)通过探究发现:铁生锈是铁与共同存在时发生化学反应的过程。
(2)A中加入的蒸馏水要事先煮沸,其目的是;
(3)通过探究,请你写出防止铁制品生锈的一种措施。
小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。她
设计并完成了下表所示的探究实验:
| 实验操作 |
实验现象 |
实验结论或总结 |
||
| 结论 |
总结 |
|||
| 实验一 |
取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 |
有气泡产生,木条不复燃 |
过氧化氢分解产生氧气,但是。 反应的化学方程式为: 。 |
二氧化锰是过氧化氢分解的催化剂 |
| 实验二 |
向盛水的试管中加入二氧化锰,伸入带火星的木条 |
没有明显现象 |
||
| 实验三 |
二氧化锰能加快过氧化氢的分解 |
(1)请你帮小丽同学填写上表中未填完的空格。
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用是。
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是:;
第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验。接下来的实验操作、现象和结论是:。
一般情况下,金属越活泼,与酸反应速度越快。为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下实验(如图所示):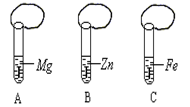
实验步骤:
①取A、B、C三支试管,分别加入2 mL浓度相同的盐酸溶液
②分别加入足量的、大小相等的Mg、Zn、Fe立即把三个相同
的气球分别套在各试管口上。实验预测与分析:
(1)写出锌与盐酸反应的化学方程式:_________________ ________。
(2)气球膨胀速度最快的是______________。(填试管编号)
(3)该实验表明,实验室一般用锌而不选用镁、铁制取氢气的主要原因是_。
(4)步骤②是实验获得成功的关键,你认为在操作过程中小组成员之间应该:________