Ⅰ、(1)已知下列两个热化学方程式:
H2(g)+ O2(g)===H2O(l) ΔH=-285.0 kJ/mol
O2(g)===H2O(l) ΔH=-285.0 kJ/mol
C3H8(g)+5O2(g)===4H2O(l)+3CO2(g) ΔH=-2220.0 kJ/mol
①已知:H2O(l)===H2O(g) ΔH=+44.0 kJ· mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式:
_________________________________________。
②实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热6262.5 kJ,则混合气体中H2和C3H8的体积比是______________。
(2)已知:P4(白磷,s)+5O2(g)===P4O10(s) ΔH=-2983.2 kJ/mol
P(红磷,s)+ O2(g)===
O2(g)=== P4O10(s) ΔH=-738.5 kJ/mol
P4O10(s) ΔH=-738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式____________________________________
相同状况下,能量较低的是________;白磷的稳定性比红磷 (填“高”或“低”)。
Ⅱ、盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式_____________________________。
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.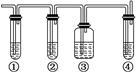
完成下列问题:
(1)图中①、②、③、④装置可盛放的试剂是:
①________;②________;③________;④________.
(将下列有关试剂的序号填入上述空格内)
| A.品红溶液 | B.NaOH溶液 |
| C.浓H2SO4 | D.酸性KMnO4溶液 |
(2)能说明二氧化硫气体存在的现象是__________________________________.
(3)使用装置②的目的是_____________________________________________.
(4)使用装置③的目的是_______________________________________________.
(5)确认含有乙烯的现象是_____________________________________________.
有机化学中有多种同分异构现象,其中有顺反异构,例如2丁烯有两种顺反异构体:A中两个—CH3在双键同侧,称为顺式,B中两个—CH3在双键两侧,称为反式,如下所示: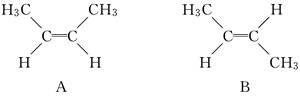
根据此原理,苯丙烯的同分异构体中除有三种位置异构外还有一对顺反异构,写出其结构简式:
(1)三种位置异构:______________,______________,______________;
(2)两种顺反异构: ______________,______________.
乙烯的产量标志着一个国家的石油化工发展水平,它是很重要的工业原料.
(1)已知聚苯乙烯塑料的单体是苯乙烯(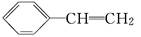 ),由苯乙烯合成聚苯乙烯塑料属于________反应;苯乙烯也能使溴水褪色,其反应的化学方程式为___________________.
),由苯乙烯合成聚苯乙烯塑料属于________反应;苯乙烯也能使溴水褪色,其反应的化学方程式为___________________.
(2)乙烯的某同系物A(化学式为C5H10)和H2加成后的产物的一氯取代物有3种,试写出A可能有的结构简式:___________________________________________________.
有A、B、C三种有机物,A是一种环状烃,其中碳、氢两种元素的质量比为6∶1,气体A的质量是相同状况下同体积空气质量的1.448倍.B是A的同分异构体,能使酸性高锰酸钾溶液退色.B跟溴水反应生成C.则A、B、C的结构简式分别是________________,__________________,_________________________.
下面是我们已经学过的烷烃或烯烃的化学反应,请写出其反应的化学方程式,指出反应类型.
(1)乙烷与氯气生成一氯乙烷的反应:____________________________________
____________________,__________________.
(2)乙烯与溴水的反应:_______________________________________________,
________.
(3)乙烯与水的反应:__________________________________________________,
________.
(4)乙烯生成聚乙烯的反应:_______________________________________________,
____________.