B.【实验化学】
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下: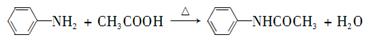
已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
| 物质 |
熔点 |
沸点 |
溶解度(20 ℃) |
| 乙酰苯胺 |
114.3 ℃ |
305 ℃ |
0.46 |
| 苯胺 |
-6 ℃ |
184.4 |
3.4 |
| 醋酸 |
16.6 ℃ |
118 ℃ |
易溶 |
实验步骤如下:
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照下图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
请回答下列问题:
(1)步骤1中加入锌粉的作用是____。
(2)步骤2中控制温度计示数约105 ℃的原因是____。
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是____。抽滤装置所包含的仪器除减压系统外还有________、________(填仪器名称)。
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是____。
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质)的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为;
在加高锰酸钾溶液前,若pH较低,对除杂的影响是;
(2) 反应③的反应类型为,过滤得到的滤渣中,除了过量的锌外还有;
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2。取干操后的滤饼11.2g,煅烧后可得到产品8.1 g,则x等于 。
通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:
H2C2O4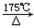 H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置可以重复使用)。酒精喷灯可作高温热源。
H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置可以重复使用)。酒精喷灯可作高温热源。
请回答下列问题:
(1)检验装置A气密性良好的方法是
(2)从左到右连接装置的顺序是:A→;
(3) 证明CO存在的实验现象是;
(4)本实验尾气处理的方法是。
食盐是日常生活的必需品,也是重要的化工原料。
粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳。实验室提纯NaCl的流程如下: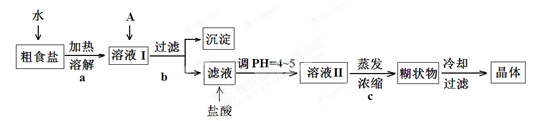
(1) 欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的多种试剂,按滴加顺序依次为i NaOH iiii。(填化学式)
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i:;加入试剂iii:。
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为。(从提供的试剂中选)
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如下:
欲用上浓盐酸配制实验所需浓度的稀盐酸480ml,
①配制需要的玻璃仪器有(填仪器名称)。
②需量取的浓盐酸的体积为:。
(15分)【化学——选修2化学与技术】
碘酸钾是一种白色结晶,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘;在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如图所示,在反应器中发生反应的化学方程式为:6I2 + 11KClO3 + 3H2O=====6KH(IO3)2 + 5KCl + 3Cl2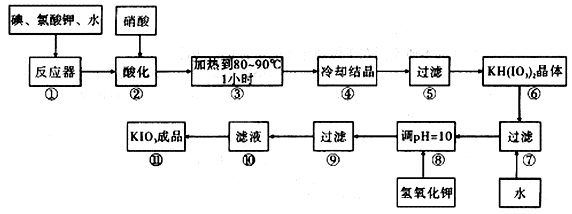
试回答下列问题:
(1)步骤① 反应器发生的反应中,转移电子总数为
(2)步骤② 中,用硝酸而不用HI,其原因可能是
(3)步骤③ 要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为
(4)实验中涉及两次过滤,在实验室进行过滤实验中,用到的玻璃仪器有
(5)步骤⑧ 用氢氧化钾调节溶液的pH,反应的化学方程式为:
(6)参照下表碘酸钾的溶解度,步骤⑾得到碘酸钾晶体,你建议的方法是
(14分)氢化钙((CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。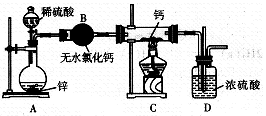
(1)装置B的作用是;装置D的作用是。
(2)利用图示实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活
塞,(请按正确的顺序填人下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是。
(4)甲同学设计了一个实验,测定上述实验中得到的氢化钙的纯度。请完善下列实验步骤:
①样品称量;
②加入溶液(填化学式),搅拌、过滤;
③(填操作名称);
④(填操作名称);
⑤称量碳酸钙。
(5)乙同学利用下图所示装置测定上述实验中得到的氢化钙的纯度。他称取46mg所制得的氢化钙样品,记录开始时注射器活栓停留在lO.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定)。试通过计算求样品中氢化钙的纯度:。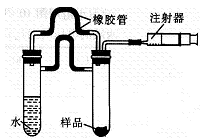
(6)请你再设计一种测定氢化钙纯度的方法:。