选考【化学——选修3:物质结构与性质】(15分)四种常见元素的性质或结构信息如F表所示,请问答下列问题。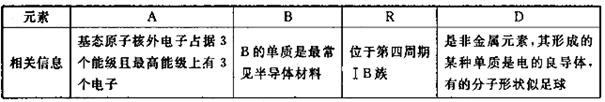
(1)R的基态原子价层电子排布式为________,这四种元素的第一电离能由大到小的顺序为________________(写元素符号)。
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为_______,任意写出一种中心原子存在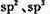 两种杂化类型的物质的结构简式________,与A的常见单质互为等电子体的上述元素的氧化物是________。
两种杂化类型的物质的结构简式________,与A的常见单质互为等电子体的上述元素的氧化物是________。
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中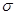 键之比为________,已知有下列两种数据:
键之比为________,已知有下列两种数据:
请解释键能大小与两种氧化物熔点、沸点高低差异过大的原因________。
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为________。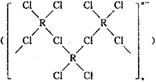
(5)A元素能形成组成为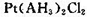 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是________(填“极性”或“非极性”)分子,
②P的结构简式为________(AH3配体作为一个整体写)。
针对下面9种元素,完成以下各小题
| 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)单质为有色气体的元素是___________(填名称)。
(2)③与④⑤简单离子的半径由大到小的顺序为___________(填离子符号)。
(3)元素②的单质的电子式为__________。
(4)最高价氧化物对应的水化物酸性最强的是___________________。(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为___________。
(6)⑦的单质的用途正确的是___________。
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是____,写出一个能表示二者非金属性强弱关系的化学方程式为:__________。
钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应为:
Zn + 2OH--2e- =" ZnO" + H2O Ag2O + H2O + 2e- =" 2Ag" + 2OH-
电池的负极是(填电极材料),正极发生的是反应(填反应类型),
总反应式为。
(共10分)用下列:①H2O ②H2O2③Ba(OH)2④Na2O2⑤Cl2⑥Ar⑦CO2等物质填空。 (1—4小题填序号)
(1)由离子键和非极性键构成的是
(2)由极性键和非极性键构成的是
(3)不存在化学键的是
(4)共价化合物有
(5)写出下列物质的电子式:Na2O2
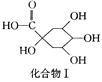
绿原酸是一种新型高效的酚型天然抗氧化剂,在食品行业有着广泛的用途,在某些食品中可取代或部分取代目前常用的人工合成的抗氧化剂。
绿原酸
 +
+
(1)在反应①中,绿原酸与水按1∶1发生反应,则绿原酸的分子式为。
(2)1 mol化合物Ⅰ与足量金属钠反应生成标准状况下氢气体积为。
(3)写出化合物Ⅱ与足量浓溴水反应的化学反应方程式:。
(4)1 mol化合物Ⅱ与足量的试剂X反应得到化合物Ⅲ(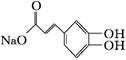 ),则试剂X是。
),则试剂X是。
按要求完成下列问题:
(1) 的名称_________________。
的名称_________________。
(2)4―甲基―2―戊烯的键线式为_________________。
(3)写出乙醛与新制氢氧化铜反应化学方程式_________________。
(4)苯的硝化反应方程式_________________。
(5)硬脂酸甘油酯在NaOH溶液中的皂化反应方程式_________________。