t℃时,将3mol A和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应: 3A(g) + B(g) 
 C(g)
C(g)
2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1) 从开始反应至达到平衡的状态,生成C平均反应速率为 .
(2)  = ;平衡常数K= .
= ;平衡常数K= .
(3) 若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母)
A、向正反应方向移动
B、向逆反应方向移动
C、平衡不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新平衡,此时B的物质的量为n(B)= mol。
ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
| 金属离子 |
Fe3+ |
Al3+ |
ZrO2+ |
| 开始沉淀时pH |
1.9 |
3.3 |
6.2 |
| 沉淀完全时pH |
3.2 |
5.2 |
8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)===CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
| H2O2/% |
5 |
10 |
15 |
20 |
25 |
30 |
| CaO2/% |
62.40 |
63.10 |
63.20 |
64.54 |
62.42 |
60.40 |
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因: 。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05 g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入30 mL蒸馏水和2 mL盐酸(3 mol·L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5 mL KI溶液(100 g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后________,用硫代硫酸钠标准溶液继续滴定,________,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2===Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是 。
(3)加入KI溶液后发生反应的离子方程式为 。
(4)请补充完整实验步骤4中的内容:____________;____________。
下图为实验室制取蒸馏水的实验装置图请根据图示回答下列问题: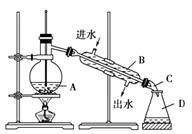
(1)指出图中两处 明显的错误:①_____________,②_______________。
(2)仪器A、B、C的名称分别是_________、____________
(3)实验时,A中除加入少量自来水外还需要加入少量_________,其作用是_________________。
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:____________;
(2)写出“联合制碱法”有关反应的化学方程式:_______________;_____________。
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2来源于_______,“氨碱法”中CO2来源于__________。
目前,我国采用“接触法”制硫酸,设备如图所示: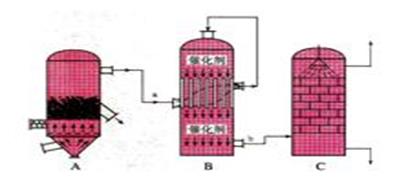
(1)图中设备A的名称是______________,该设备中主要反应的化学方程式为____________。
(2)有关接触法制硫酸的下列说法中,不正确的是______________________
| A.二氧化硫的接触氧化在接触室中发生 |
| B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫 |
| C.B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
| D.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
(3)用18 mol/L 的浓硫酸配制100 mL 3.6 mol/L 稀硫酸,所需浓硫酸的体积是_______。