[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 .。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
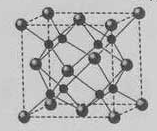
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a= 0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
(12分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、 “偏小”、“无影响”)。
将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)所用盐酸中HCl的物质的量浓度c(HCl)=;
(2)反应中生成的H2在标准状况下的体积V(H2)=。
某烧杯中盛有100 mL FeCl3和CuCl2的混合液,混合溶液中c(FeCl3)=1 mol/L,
c(CuCl2)=1 mol/L。请回答:
(1)该混合溶液中铁离子的物质的量为;铜离子的物质的量为;
(2)该混合溶液中氯离子的物质的量n(Cl-)=;
(3)该混合溶液中氯离子的物质的量浓度c(Cl-)=。
有一包白色粉末,含有Ba(NO3)2、CaCl2、K2CO3中的2种。为确定其成分,现做以下实验。结合资料卡片中的物质溶解性,试分析:
资料卡片:一些物质的溶解性
| OH- |
CO |
Cl- |
NO |
|
| Na+ |
溶 |
溶 |
溶 |
溶 |
| Ca2+ |
微 |
不 |
溶 |
溶 |
| Ba2+ |
溶 |
不 |
溶 |
溶 |
| Mg2+ |
不 |
微 |
溶 |
溶 |
(1)将少量白色粉末加入足量水中,振荡,有白色沉淀生成。
通过上述现象可初步判断原白色粉末中一定含有的物质是(填化学式)。
(2)过滤得到(1)中所产生的白色沉淀及滤液。
实验室中进行过滤操作时,通常需要下列玻璃仪器中的(填序号)。
a. 玻璃棒 b. 普通漏斗 c. 烧杯 d. 容量瓶
(3)再继续向滤液中加入AgNO3溶液和过量稀硝酸,最终有白色沉淀生成。
第(3)步实验及现象说明,原白色粉末中一定还含有的物质是(填化学式),若将(2)中的白色沉淀溶于稀硝酸时,发生反应的化学方程式是
。
下列4组物质均有一种物质的类别与其它3种不同
A.CaO、Na2O、CO2、CuO B. H2、C.P、Cu
C.O2、Fe、Cu、Zn D. HCl、H2O、H2SO4、HNO3
以上四组中与其它3种类别不同的物质依次是(填化学式)
A; B; C; D。