25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
| 序号 |
① |
② |
③ |
④ |
| 溶液 |
NaCl |
CH3COONH4 |
NaF |
NaHCO3 |
| pH |
7.0 |
7.0 |
8.1 |
8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)0.1 mol/L
CO2溶于水生成碳酸。已知下列数据:
| 弱电解质 |
H2CO3 |
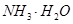 |
| 电离平衡常数(250C) |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
Kb=1.77×10-5 |
现有常温下1 mol· L-1的(NH4)2CO3溶液,已知NH4+的水解平衡常数 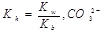 第一步水解的平衡常数
第一步水解的平衡常数 。下列说法正确的是
。下列说法正确的是
A.由数据可判断该溶液呈酸性
B.c(NH4+)>c(HCO3-)>c(CO32-)>c(NH3·H2O)
C.c(NH4+)+c(NH3·H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
下图曲线a和b是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是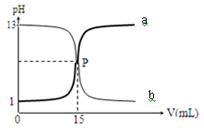
| A.NaOH溶液的浓度为0.1 mol·L-1 |
| B.P点时可能未完全反应,溶液呈可能呈酸性 也可能呈碱性 |
| C.曲线a是盐酸滴定氢氧化钠溶液的测定曲线 |
| D.本实验的指示剂不能用甲基橙,只能用酚酞 |
在某2L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g) 3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是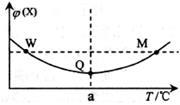
| A.M点时,Y的转化率最大 |
| B.升高温度,平衡常数减小 |
| C.平衡后充入Z达到新平衡时Z的体积分数增大 |
| D.W,M两点Y的正反应速率相等 |
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是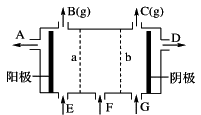
| A.b是阳离子交换膜,允许Na+通过 |
| B.从A口出来的是NaOH溶液 |
| C.阴极反应式为4OH--4e-= 2H2O+O2↑ |
| D.Na2SO4溶液从G口加入 |
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。SnSO4的实验室制备设计路线如下: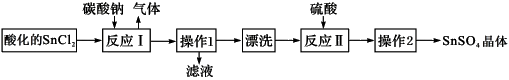
下列有关说法正确的是
| A.SnCl2酸化是为了防止溶解时发生水解 |
| B.反应I中发生的离子反应为:CO32-+2H+=CO2↑+ H2O |
| C.漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2-3次 |
| D.操作1为过滤,操作2为盐析 |