研究NO2 、SO2 、CO等大气污染气体的处理具有重要意义,完成下列问题:
I.已知:2SO2(g) + O2(g) 2SO3(g) ΔH1= —196.6 kJ·mol―1
2SO3(g) ΔH1= —196.6 kJ·mol―1
2NO(g) + O2(g) 2NO2(g) ΔH2= —113.0 kJ·mol―1
2NO2(g) ΔH2= —113.0 kJ·mol―1
(1)反应NO2(g) + SO2(g) SO3(g) + NO(g)的ΔH= 。
SO3(g) + NO(g)的ΔH= 。
(2)硫酸工业尾气中的SO2可利用氨水吸收,写出该反应的方程式____________________。
II.汽车尾气是城市空气污染的一个重要因素,常用以下反应净化汽车尾气:
2NO(g)+2CO(g) 2CO2(g)+N2(g)
2CO2(g)+N2(g)
在某温度T1℃下,2L密闭容器中充入NO 、CO各0.4mol,测得不同时间的NO和CO物质的量如下表:
| 时间(s) |
0 |
2 |
4 |
6 |
8 |
10 |
| n(NO)(mol) |
0.4 |
0.32 |
0.26 |
0.22 |
0.20 |
0.20 |
(3)反应在4s内的平均速率为v(CO)= mol·L-1·s-1
(4)上述反应达到平衡后,继续加入NO 、CO、CO2各0.2mol和N2 mol时,平衡不移动。
(5)在上述条件下该反应能够自发进行,如果把温度从T1℃升高到T2℃,平衡常数K将 (填写“变大”、“变小”、“不变”)。
III.一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中的固体电解质是Y2O3-Na2O,O2ˉ可以在其中自由移动,
(6)O2ˉ移向电池 极(填“正”或“负”),
(7)负极的反应式为 。
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol.
2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol.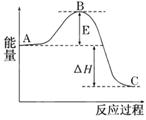
请回答下列问题:
(1)图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________.该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是
(2) 图中反应是(填“吸热”或“放热”)反应,该反应(填“需要”或“不需要”)提供能量。
(3)如果反应速率v(SO2)为0.05 mol/(L·min),
则v(O2)=__________mol/(L·min)、v(SO3)=________ mol/(L·min).
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程).
(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)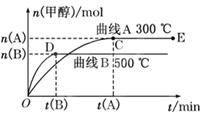
根据题意完成下列问题:
(1)反应达到平衡时,平衡常数表达式K=______,升高温度,K值______(填“增大”“减小”或“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________.
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的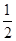 ,下列有关该体系的说法正确的是____.
,下列有关该体系的说法正确的是____.
| A.氢气的浓度减少 | B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 | D.重新平衡时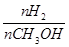 增大 增大 |
把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) ==CO2(g) △H1<0 ①
途径Ⅱ:先制成水煤气:C(s) +H2O(g) ==CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2 CO(g)+O2 (g) ==2CO2(g) △H3<0 ③
2H2(g)+O2 (g) ==2H2O(g) △H4<0 ④
请回答下列问题:
(1) 途径I放出的热量( “大于”“等于”或“小于”) 途径Ⅱ放出的热量。
(2) △H1、△H2、△H3、△H4的数学关系式是。
(3)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为
化学平衡常数K的应用具有现实意义,试完成以下填空:
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________, K值大小与温度的关系是:温度升高,K值_________________。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在密闭容器中,将2.0 mol CO与10mol H2O混合加热到800℃,达到下列平衡:CO(g)+H2O(g) 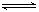 CO2(g)+H2(g) K=1.0,则CO的转化率为________ 。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol•L-1,c(H2O)=6.0mol•L-1,c(CO2)=3.0mol•L-1,c(H2)= 4.5mol•L-1,则此时该反应向_________ 方向移动。
CO2(g)+H2(g) K=1.0,则CO的转化率为________ 。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol•L-1,c(H2O)=6.0mol•L-1,c(CO2)=3.0mol•L-1,c(H2)= 4.5mol•L-1,则此时该反应向_________ 方向移动。
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量_____________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
(4) 已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) △H=" -" 870.3 kJ• mol-1
②C(s)+O2(g) ===CO2(g)△H=" -393.5" kJ• mol-1
③H2(g)+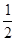 O2(g) ===H2O(l) △H=" -" 285.8 kJ• mol-1
O2(g) ===H2O(l) △H=" -" 285.8 kJ• mol-1
试写出由C和H2和O2生成CH3COOH的热化学方程式________________________________