有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大2,元素Z形成的金属单质在日常生活中应用最广泛。请回答:
Ⅰ.若X是周期表中最活泼的非金属元素。
(1)X—离子的结构示意图为 。
(2)Y的最简单氢化物在液态时类似水,也能微弱电离且产生电子数相同的两种离子,其电离方程式为_______;
(3)写出过量的单质Z与元素Y的最高价氧化物对应的水化物浓溶液反应的离子方程式 。
Ⅱ.若X的一种单质易溶在CS2中。
(4)元素的非金属性X____Y(填“>”或“<”),下列各项中,能说明这一结论的事实有____(填序号)
A.XO2能与Na2YO3溶液生成H2YO3
B.X的氢化物稳定性强于Y的氢化物稳定性
C.X的单质的熔点低于Y单质的熔点
D.X和Y在周期表中的位置
(5)已知:①C(s)+ O2(g)=CO2(g) 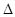 H=a kJ· mol-1;
H=a kJ· mol-1;
②CO2(g) +C(s)=2CO(g) 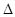 H=b kJ· mol-1;
H=b kJ· mol-1;
③Y(s)+ O2(g)=YO2(s) 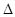 H=c kJ· mol-1。
H=c kJ· mol-1。
工业上生产Y的热化学方程式为____________。
Ⅲ.含Z的化合物A(化学式为K2ZO4)极易溶于水,但静置一段时间后转化为红褐色沉淀,同时产生O2。
(6)化合物A溶于水后的变化 (用离子方程式表示)。查阅资料发现,加入下列物质中的 可提高A在水中的稳定性。
A.Na2CO3 B.KI C.NH4NO3 D.KOH
下图是中学化学一些常见元素的单质及化合物的转化关系,已知:A是金属单质,B是淡黄色固体,G是无色气体,I是红棕色气体,反应②是工业上重要反应。请按要求完成下列各题内容: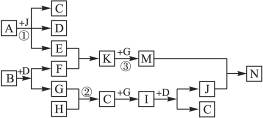
(1)写出B的电子式:___________________;D的结构式是__________________。
(2)反应③的实验现象为________________________________________________。
(3)反应①的离子方程式为_______________________________________________。
(4)反应②的化学方程式为________________________________________________。
250 ℃时将24.8 g NaOH和NaHCO3的混合物放在密闭容器中加热,充分反应后,称得剩余固体的质量为23 g。请回答:
(1)NaOH和NaHCO3的物质的量之比________________1(填“>”“<”或“=”)。
(2)NaOH的物质的量为______________________________。
已知单质铁溶于一定浓度的硝酸溶液中,反应的离子方程式为:
aFe+bNO +cH+
+cH+ dFe2++fFe3++g NO↑+hN2O↑+kH2O(化学计量数均为正整数)。回答下列问题:(1)根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是(用一个代数式表示。下同)。
dFe2++fFe3++g NO↑+hN2O↑+kH2O(化学计量数均为正整数)。回答下列问题:(1)根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是(用一个代数式表示。下同)。
(2)根据反应中离子电荷守恒,可得b、c、d、f的关系式是。
(3)根据反应中电子转移的总数相等,可得d、f、g、h的关系式是,若a等于12,且铁和稀硝酸恰好完全反应,则b的取值范围是,c的取值范围是。
A是氮、氢两种元素组成的化合物,它和氨气与H2O2和H2O之间在结构上的关系相似。A分子中N和H的质量比为7∶1。请填写以下空白:
(1)A的化学式为__________。
(2)A的水溶液呈__________(填“酸”“碱”“中”)性,1 mol A最多可以与__________mol HCl(或NaOH)发生反应生成正盐,写出生成的盐中含有氮原子的离子的电子式:__________
__________________________________。
(3)A在氧化还原反应中也与H2O2相似,既可作氧化剂,也可作还原剂。根据价态分析产生这种情况的原因:_____________________________________________________________。
现有物质A、B、C、D、E、F、G、H、M、N,其中C、H为常见金属,且混合气体A在常温下不与空气接触时能发生如图所示的变化(其他有关反应条件均略去)。试完成下列问题: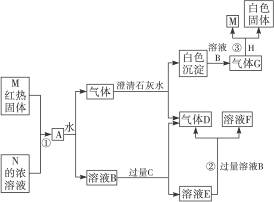
(1)写出C、D、H的化学式___________、___________、___________。
(2)写出反应①②③的化学方程式:
①_______________________________________________,
②_______________________________________________,
③_______________________________________________。