亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。
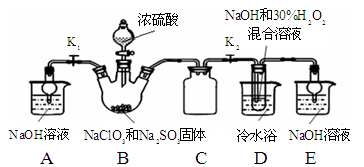
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要 (填仪器名称);
(2)装置C的作用是 ;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为 。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作iii。
i.55℃蒸发结晶;
ii.趁热过滤;
iii. ;
iv.低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是 ;
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是 ;
②所称取的样品中NaClO2的物质的量为 (用含c、V的代数式表示)。
现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A)(B)。
(2)如果(A或B)不能,说明其原因。
(3)如果(A或B)可以,则写出正、负极材料及其电极反应式,电解质溶液
负极:;。
正极:;。
电解质溶液:。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题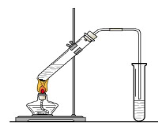
(1)在大试管中按一定比例将乙醇、乙酸混合后充分加热,在右边小试管中未收集到有香味的液体(气密性良好),原因可能是:。
(2)右边小试管中应加入的试剂是:;其作用是。
(3)下列描述能说明乙醇与乙酸的酯化反应已达到该反应的限度的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(4)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图: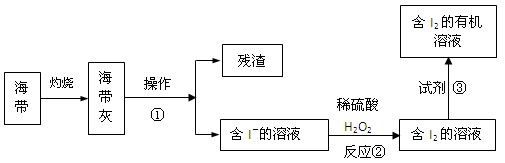
操作①的名称是;反应②的离子方程式是,下述物质中可做试剂③的是。
| A.乙醇 | B.苯 | C.乙酸 | D.四氯化碳 |
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。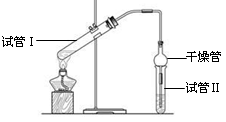
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中 试剂 |
有机层的 厚度/cm |
| A |
2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 |
饱和Na2CO3 溶液 |
3.0 |
| B |
2 mL乙醇、1 mL乙酸 |
0.1 |
|
| C |
2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 |
0.6 |
|
| D |
2 mL乙醇、1 mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1。
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________。
现提供如下除杂试剂和提纯方法:
| 除杂试剂 |
①酸性高锰酸钾溶液 ②溴水 ③饱和碳酸钠溶液 ④氢氧化钠溶液 |
| 提纯方法 |
A蒸馏 B萃取 C分液 D洗气 |
从上表中选择合适的除杂试剂和提纯方法填入下表空格内(填序号或字母),下表甲栏括合内为杂质。
| 甲 |
除杂试剂 |
提纯方法 |
| 甲烷(乙烯) |
||
| 乙酸乙酯(乙酸) |
(12分)
实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
(1)如何检查装置A的气密性
(2)为了安全,在点燃D处的酒精灯之前,在b处必须。
(3)装置B的作用是
装置C中装的液体是
(4)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生的化学反应方程式是
(5)若FeO和Fe2O3固体混合物的质量为23. 2g,反应完全后,U型管的质量增加7.2g则混合物中Fe2O3的质量为_。