过氧化钙()是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在溶液中加入;
②不断搅拌的同时加入30% ,反应生成沉淀;
③经过陈化、过滤,水洗得到,再脱水干燥得到。
完成下列填空
2.第①步反应的化学方程式为。第②步反应的化学方程式为。
3.可循环使用的物质是。
工业上常采用过量而不是过量的方式来生产,这是因为。
4.检验是否洗净的方法是。
5.加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是、。
6.已知在350迅速分解生成和。下图是实验室测定产品中含量的装置(夹持装置省略)。

若所取产品质量是,测得气体体积为(已换算成标准状况),则产品中的质量分数为(用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有。
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品。用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是利用盐酸和石灰石制取CO2的装置,A中发生反应的化学方程式为_____________.
(2)填写表中空格:
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| C |
||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________________。
在此反应中,过氧化钠的作用是_______(填序号) ①氧化剂;②还原剂;③既是氧化剂又是还原剂;④既不是氧化剂,又不是还原剂。
(4)试管F中收集满气体后,下一步实验操作是:___________________________。
为了保护环境,充分利用资源,某研究小组通过如图简化流程,将工业制硫酸的硫铁矿烧渣(含Fe2O3.SiO2.Al2O3等)转变成重要的工业原料FeSO4(反应条件略)
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是_____ _____.
(2)检验第II步中Fe3+是否完全还原,应选择__________(填字母编号).
| A.KMnO4溶液 | B.KSCN溶液 | C.KCl溶液 | D.KOH |
(3)第III步加FeCO3调溶液pH=6时,利用相关数据计算,(已知Ksp Al(OH)3=1.9×10﹣33,当离子浓度小于1×10﹣5mol•L﹣1时,可认为沉淀完全)判断Al3+_______(填“是”或“否”)能沉淀完全。
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)═2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是__________.
(5)FeSO4溶液在加热浓缩结晶时要注意_________________________________,FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2═Fe+2Li2S,正极反应式是__________.
环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮: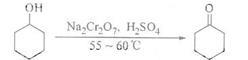
环己醇、环己酮和水的部分物理性质见下表:
| 物质 |
沸点(℃) |
密度(g-cm-3,200C) |
溶解性 |
| 环己醇 |
161.1(97.8)* |
0.9624 |
能溶于水 |
| 环己酮 |
155.6(95)* |
0.9478 |
微溶于水 |
| 水 |
100.0 |
0.9982 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静置,分液;d 加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是 (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用红外光谱图,可确定环己酮分子含官能团名称
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线: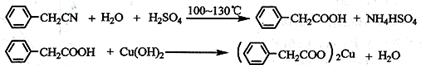
制备苯乙酸的装置示意图如右(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器c的作用是 ;仪器b的名称是 ,其作用是 。反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。
A 分液漏斗 B 漏斗 C 烧杯 D 直形冷凝管 E 玻璃棒
(3)提纯粗苯乙酸的方法是 ,最终得到44g纯品,则苯乙酸的产率是 。
(4)用CuCl2•2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
(6)在实际操作时,发现b中液体不容易滴下来,你认为应将b改为 (填仪器名称)即可解决此问题。
(每空2分,共10分)绿矾(FeSO4·7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O===(NH4)2SO4·FeSO4·6H2O↓。其流程可表示为: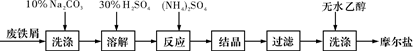
(1)洗涤中Na2CO3的主要作用是_____________。
(2)结晶过程中需要加热蒸发溶剂,加热到_____________(填字母)时,停止加热,冷却结晶。
| A.沸腾 | B.液体表面出现晶膜 |
| C.析出少量晶体 | D.快蒸干,还有少量液体 |
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,过滤速度较快的原因是___。
(4)用无水乙醇洗涤的目的是①___________,②__________。