下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。
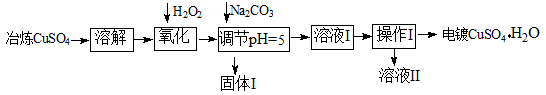
已知:①Fe3+ Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 kg。
(2)氧化步骤中发生的离子反应方程式为① 。
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为______________。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式 。
某学生为了探究钠与CO2的反应,利用如图装置进行实验.(已知PdCl2能被CO还原得到黑色的Pd)
(1)请将上图各装置连接完整(填写装置中字母):c接f, 接 , 接 ,接 。
(2)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是 。
| A.NaNO3溶液 | B.CCl4 | C.苯 | D.稀硝酸 |
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到 时再点燃酒精灯。
(4)反应过程中CO2足量,假如反应过程中有下列两种情况,分别写出两种情况下钠与CO2反应的化学方程式 。
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体 。
Ⅱ.装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,且溶液中还有固体残留 。
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是________;
(2)实验过程中,装置B中发生的现象是________,这个现象分别说明SO2具有的性质是________;
(3)装置C中Na2S溶液在空气中不易保存,时间长了会变浑浊,原因是(用离子方程式表示)____;
(4)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________________;
(5)如果把分液漏斗中的浓硫酸换成浓HNO3,对此实验是否有影响________(填“是”或“否”)。请说明你的理由___________________;
(6)工业上用黄铜矿(CuFeS2)冶炼铜,副产品中也有SO2,冶炼铜的反应为:8CuFeSO2+2IO2 8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中 Fe 的化合价为+2,反应中被还原的元素是________(填元素符号),当生成0.8mol铜时,此反应转移的电子数目是________。
8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中 Fe 的化合价为+2,反应中被还原的元素是________(填元素符号),当生成0.8mol铜时,此反应转移的电子数目是________。
某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数的探究实验,他们提出下列实验方案。
【方案一】气体分析法。
(1)甲同学用图1所示装置,把xg的混合物与足量稀硫酸反应后,测定产生的C02气体的体积.实验开始时检查该装置气密性的方法是 _____________________;
(2)乙同学用图2代替图1中的收集装置,则所测CO2气体的体积_________(填“偏大”、“偏小”、“不变”),你的改进方案是_____________________;
(3)丙同学用图3装置测定CO2的质量,该装置存在较多缺陷,从而导致实验误差,请你填写其中的三点缺陷:I _____________________,Ⅱ_____________________,Ⅲ_____________________;
【方案二】沉淀分析法(如图所示).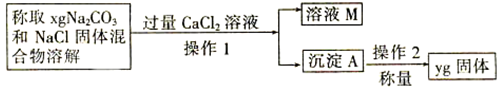
(4)操作1的名称是______________,操作2的名称是___________,在进行操作2之前,应判断是否沉淀完全,判断的方法是_____________________;
(5)根据沉淀分析法,该固体混合物中Na2CO3质量分数的计算式为_____________________。
为了验证炭粉与浓硫酸作用确实有二氧化碳气体生成,某同学创设如下图所示的A、B、C三个装置进行实验,其中省略了课本上炭粉与浓硫酸反应的发生装置图。已知C中的KMnO4酸性溶液是足量的,具有强氧化性,还原性的SO2气体经过KMnO4酸性溶液后能全部被吸收氧化,据此,请回答下列问题。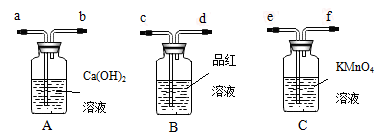
(1)炭粉与浓硫酸在加热条件下反应的化学方程式为_____________________
(2)由(1)产生的混合气体流经装置A、B、C的先后顺序是______、______、______(填A、B、C),气流依次经过装置管口顺序号为(填管口序号a、b、c、d、e、f);气体发生装置导管口接______,然后______接_____,______接_____;
(3)装置B的作用是__________________,装置B中观察到的现象是__________________;
(4)装置A中观察到的现象是_________________,得到的结论是_________________。
Ⅰ.实验室可用下图所示装置制取氨,再用氨与氧化铜反应以检验氨的某些性质(最后C装置中氧化铜变成铜, 且导管排出的是氮气和水蒸汽)。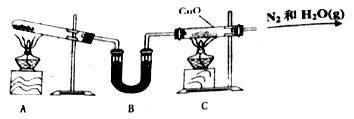
(1)写出A中反应的化学方程式:___________________
(2)写出C中反应的化学方程式:___________________此反应中氨表现出_______性。
(3)B中盛装的固体是______________,其作用是___________________
(4)停止实验时,应先撤______装置中的酒精灯(填“A”或“C”)。
Ⅱ.工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别。路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。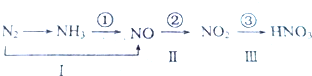
(1)完成下列反应的化学方程式:
写出①的化学方程式:__________________;写出Ⅲ的化学方程式:__________________;
(2)下列环境问题与NO2的排放有关的是_______(填字母序号)
A赤潮B光化学烟雾C臭氧空洞D温室效应 E酸雨