为了验证炭粉与浓硫酸作用确实有二氧化碳气体生成,某同学创设如下图所示的A、B、C三个装置进行实验,其中省略了课本上炭粉与浓硫酸反应的发生装置图。已知C中的KMnO4酸性溶液是足量的,具有强氧化性,还原性的SO2气体经过KMnO4酸性溶液后能全部被吸收氧化,据此,请回答下列问题。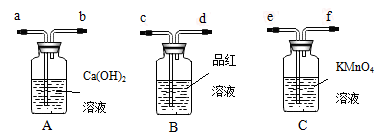
(1)炭粉与浓硫酸在加热条件下反应的化学方程式为_____________________
(2)由(1)产生的混合气体流经装置A、B、C的先后顺序是______、______、______(填A、B、C),气流依次经过装置管口顺序号为(填管口序号a、b、c、d、e、f);气体发生装置导管口接______,然后______接_____,______接_____;
(3)装置B的作用是__________________,装置B中观察到的现象是__________________;
(4)装置A中观察到的现象是_________________,得到的结论是_________________。
用铜片、锌片和稀硫酸及若干其他器材组合成一个原电池,画出装置图并回答 (1)画出装置图。
(2)从理论上讲,预期看到的现象是
(3)实验过程中,观察到锌片上有少量气泡冒出,铜片上有大量气泡冒出。试解释:。
(4)此电池的负极是,正极的电极反应式是。
(5)该电池工作一段时间,将两个电极小心取出洗涤并晾干,经称量发现锌片比原来减少3.25 g。请计算理论上导线中共通过了mol电子
某校化学学习小组拟验证NO能被氨气还原并测定其转化率,设计如下实验:
参考知识:NO气体 与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(Ⅱ):NO+FeSO4=Fe(NO)SO4
与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(Ⅱ):NO+FeSO4=Fe(NO)SO4
试回答下列问题:
⑴实验室用氯化铵与氢氧化钙固体制备氨气,应选用的装置是
该反应的化学方程式
实验室通常用法收集氨气,检验该气体是否收集满方法
⑵装置③、④若用同一装置,则该装置中所盛装的药品是
| A.Na2O2 | B.浓硫酸 | C.P2O5 | D.碱石灰 |
⑶装置⑥中,粗玻璃管X的作用,装置⑦的作用
⑷装置⑥的广口瓶中,除生成Fe(NO)SO4外,还有白色沉淀生成,写出生成该沉淀的离子方程式
⑸若参加反应的NO为2.688L(标准状况,下同),氨气过量,最后收集到2.016LN2,则装置⑤中NO的转化率为
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
⑴若假设1成立,则实验现象是。
⑵若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?,简述你的理由(不需写出反应的方程式 )
⑶若固体粉末完全溶解, 向所得溶液中滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是,写出实验过程中发生的氧化还原反应的离子方程式
探究延伸:若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
⑷实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为。
⑸某铝土矿样品经测定是由Al2O3、Fe2O3、 FeO、 SiO2等氧化物组成,取样品适量放入烧杯中,加入稀硫酸将其溶解,过滤,取滤液少量于试管中,若证明滤液中含有+2价的铁,选用的试剂和现象为.
现行中学教材中,有以下化学实验:
A.溴乙烷的水解 B.浓硫酸跟乙醇反应制乙烯 C.乙醛还原新制的氢氧化铜;
D.乙酸乙酯的制取 E.石油的蒸馏 F.葡萄糖的银镜反应 G.乙酸乙酯的水解。
对以上实验,按下列各操作的要求,用字母A、B、C…完成以下填空:(多填扣分)
(1)需用水浴加热的是;
(2)实验装置不需要检查气密性的是 ;
;
(3)为防止液体暴沸,常需加少量碎瓷片的是;
(4)需用温度计的是。
请选用适当的试剂和分离装置除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中。
试剂:a.水 b.NaOH溶液 c.溴的CCl4溶液 d.饱和Na2CO3溶液
e.新制CaO f.饱和NaCl溶液
分离装置:
| A.分液 | B.过滤 | C.洗气 | D.蒸馏 F.盐析 |
| 混合物 |
需加入的试剂 |
分离方法 |
苯(苯酚) |
||
| 高级脂肪酸钠(甘油) |
||
乙醇(水) |
||
| 乙酸乙酯(乙酸) |