三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
⑴若假设1成立,则实验现象是 。
⑵若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? ,简述你的理由(不需写出反应的方程式 )
⑶若固体粉末完全溶解, 向所得溶液中滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出实验过程中发生的氧化还原反应的离子方程式
探究延伸:若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
⑷实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
⑸某铝土矿样品经测定是由Al2O3、Fe2O3、 FeO、 SiO2等氧化物组成,取样品适量放入烧杯中,加入稀硫酸将其溶解,过滤,取滤液少量于试管中,若证明滤液中含有+2价的铁,选用的试剂和现象为 .
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。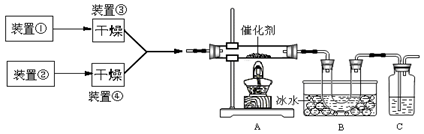
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。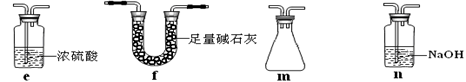
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。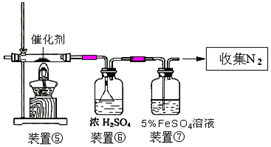
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):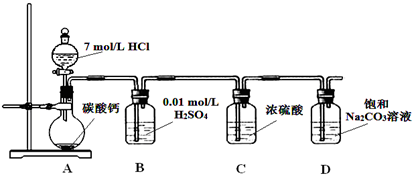
(1)请结合化学平衡移动原理解释B中溶液的作用 。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程式是 。
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器b中可选择的试剂为(任意填一种) 。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为 。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积 (填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据 (填序号)。
a.B装置实验前后质量差mg; b.F装置实验前后液面差VL
c.D装置实验前后质量差mg; d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是 。
某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)乙同学认为甲同学的结论是错误的,他的理由是 (用化学方程式表示),所以他认为应该检验 (填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。
(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号) 。
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸;④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用 。
(4)C装置中出现的现象是 ,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式 。
CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下: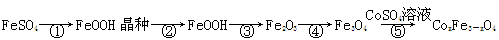
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种。生成晶种的化学方程式为;
(2)步骤②将晶种移到放有FeSO4溶液和铁皮的生长槽中,升温到60℃,吹入空气,待晶种长大到一定尺寸后,过滤、水洗、干燥,得FeOOH粉末。生长槽中放入铁皮的目的是,吹入空气的作用为。
(3)步骤③将FeOOH在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的(填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(4)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为。
(5)步骤⑤加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品。检验粗产品洗涤干净的实验操作和现象是。
(6)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4·7H2O晶体。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Co2+ |
6.9 |
9.4 |
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液):
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝。
②。
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤。
④。
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4·7H2O晶体。
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: 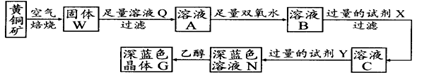
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表: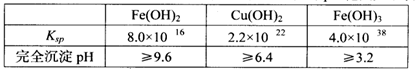
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式:;
(2)试剂X的化学式为;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为,用pH试纸测该溶液pH值的方法是;
(4)在溶液N中加入乙醇的目的是。