请选用适当的试剂和分离装置除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中。
试剂:a.水 b.NaOH溶液 c.溴的CCl4溶液 d.饱和Na2CO3溶液
e.新制CaO f.饱和NaCl溶液
分离装置:
| A.分液 | B.过滤 | C.洗气 | D.蒸馏 F.盐析 |
| 混合物 |
需加入的试剂 |
分离方法 |
苯(苯酚) |
|
|
| 高级脂肪酸钠(甘油) |
|
|
乙醇(水) |
|
|
| 乙酸乙酯(乙酸) |
|
|
如何防止铁的腐蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 |
内容 |
实验现象 |
| 1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
| 2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
| 3 |
常温下将铁丝放在潮湿空气中一个月 |
铁丝表面已变得灰暗 |
| 4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
| 5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
| 6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
回答以下问题:
⑴上述实验中发生了电化学腐蚀的是(填实验序号),在电化学腐蚀中,负极反应是_______________,正极反应是_______________。
⑵由该实验可知,可以影响铁锈蚀速率的因素是。
⑶下列对金属制品采取的防护方法不正确的是(填序号)。
A.在电线的外面包上一层塑料层
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器。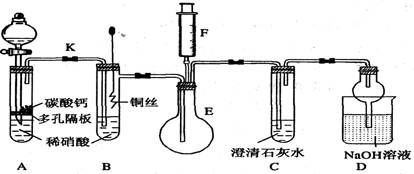
请回答有关问题:
(1) 设计装置A的目的是;
为达到此目的,应进行的操作是打开K,且打开分液漏斗活塞,当装置C中产生
时,关闭K。
(2) 在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的
现象是;
B中反应的离子方程式为:。
(3) 装置E和F的作用是;为实现此作用,其操作方法是。
(4) 装置D的作用是吸收多余的氮氧化物,防止污染空气,兼有的功能。
工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为
)发生反应:
 。某课题组用
为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
。某课题组用
为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)上述反应的平衡常数表达式:
。
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的
和
溶液均可实现上述转化,在溶液中
转化率较大,理由是。
(3)查阅文献:上述反应还可能生成碱式碳酸铅[
],它和
受热都易分解生成
。该课题组对固体产物(不考虑
)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为
;
假设二:;
假设三:。
(4)为验证假设一是否成立,课题组进行如下研究。
①定性研究:请你完成下表中内容。
| 实验步骤(不要求写出具体操作过程) |
预期的实验现象和结论 |
| 取一定量样品充分干燥,…… |
②定量研究:取26.7 的干燥样品,加热,测的固体质量随温度的变化关系如下图。某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
。
亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常
样品中含
的质量计),某研究小组设计了如下两种实验流程:
(1)气体
的主要成分是,为防止煮沸时发生暴沸,必须先向烧瓶中加入;通入N2的目的是。
(2)写出甲方案第①步反应的离子方程式:。
(3)甲方案第②步滴定前,滴定管需用
标准溶液润洗,其操作方法是。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果(填"偏高"、"偏低"或"无影响")
(5)若取样品
,按乙方案测得消耗0.01000
溶液
,则1
样品中含
的质量是g(用含
的代数式表示)。
实验室常用
与浓盐酸反应制备
(发生装置如图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是(填序号)
A.往烧瓶中加人
粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量
溶液反应,称量生成的
质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量
(过量)反应,称量剩余的
质量。
丁方案:与足量
反应,测量生成的
体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00
,用0.1000
标准溶液滴定,消耗22.00
,该次滴定测得试样中盐酸浓度为
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果(填"偏大"、"偏小"或"准确")。
) = 2.8×10-9、
= 2.3×10-11
④ 进行丁方案实验:装置如图所示(夹持器具已略去)。
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将转移到中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是(排除仪器和实验操作的影响因素)。