NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是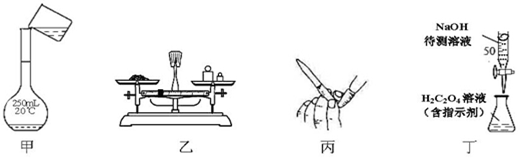
| A.用图甲所示操作转移NaOH溶液到容量瓶中 |
| B.用图乙所示装置准确称得0.1575gH2C2O4•2H2O固体 |
| C.用图丙所示操作排除碱式滴定管中的气泡 |
| D.用图丁所示装置以NaOH待测液滴定H2C2O4溶液 |
下列说法正确的是
| A.物质的量可以理解为物质的质量 |
| B.物质的量就是物质的粒子数目 |
| C.物质的量是衡量物质所含微观粒子集合的多少的一个物理量 |
| D.物质的量的单位——摩尔只适用于分子、原子和离子 |
下列科学家中提出带核的原子结构模型的是
| A.拉瓦锡 | B.道尔顿 | C.汤姆生 | D.卢瑟福 |
有BaCl2和NaCl的混合溶液2.0L,将它平均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl—离子完全沉淀。反应中消耗0.5mol H2SO4、2.0mol AgNO3。据此得知原混合溶液中的c(Na+)为( )
| A.0.5mol·L-1 | B.0.75mol·L-1 | C.1.5mol·L-1 | D.1.0mol·L-1 |
Na2O和Na2O2的下列叙述中正确的是 ( )
| A.Na2O比Na2O2稳定 | B.均可与CO2、H2O反应产生氧气 |
| C.Na2O是淡黄色固体,而Na2O2是白色固体 | D.阴阳离子个数比均为1:2 |
实验中需要2 mol·L-1的Na2CO3溶液950 mL,配制时,你认为应该选用的容量瓶的规格和称取的碳酸钠质量分别是( )。
| A.1000 mL, 212 g | B.950 mL, 201.4 g |
| C.500 mL, 286 g | D.任意规格, 572 g |