目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:
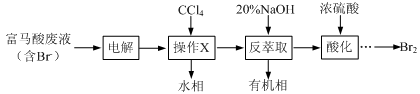
(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
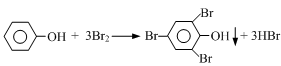
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5 mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液15 mL。(反应原理:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6)
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg/L。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”)。
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是445.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(98%)==Na2SO4 + H2O + SO2↑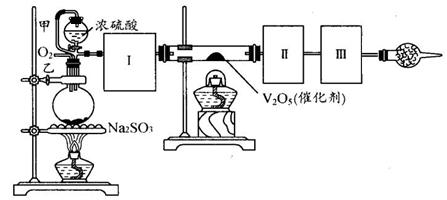
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是_______________、_______________、_______________。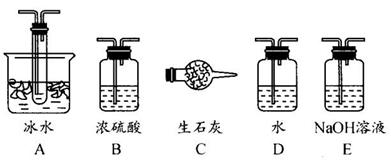
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是。
(3)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为%(用含a、b的代数式填写)
(5)尾端球形干燥管的作用是。
某化学课外活动小组研究乙醇氧化的实验并验证其产物,并从“乙醇催化氧化实验”得到一些认识有关催化剂的催化机理等问题。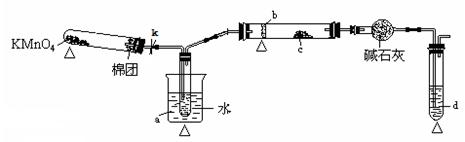
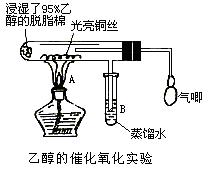 (1)甲同学其实验操作为:预先使棉花团浸透乙醇,并按下图搭好实验装置;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
(1)甲同学其实验操作为:预先使棉花团浸透乙醇,并按下图搭好实验装置;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
请回答以下问题:
①被加热的铜丝处发生的反应的化学方程式为________。
②从A管中可观察到实验现象。
(2)乙同学研究乙醇氧化的实验并验证其产物,组合一套实验装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。
①若要保证此实验有较高的效率,还需补充的仪器有___________。
理由____________。
②实验中能验证乙醇氧化产物的实验现象是__________________________。
③装置中,若撤去高锰酸钾加热部分并用夹子夹K,其它操作不变,则无水硫酸铜无明显变化,其余现象与②相同,推断燃烧管中主要反应的化学方程式______________________________。
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即在沸腾炉中煅烧黄铁矿、SO2的催化氧化及其SO3的吸收。请回答下列几个有关硫酸工业中的几个问题。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O  Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
| A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4 |
| B.b中产物用紫色石蕊试液即可检验出其中H+和SO42— |
| C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
(2)从沸腾炉中出来的炉气必须经除尘、洗涤、干燥后进入接触室,其主要目的是__________。
(3)接触室中热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是______________。
(4)接触室中主要反应是SO2的催化氧化,在生成硫酸的过程中,钒触媒(V2O5)所以能加快二氧化硫氧化的速度,除了具有吸附作用外,有人认为反应过程中还产生了一连串的中间体(如图)。c步的化学方程式可表示为_______________________。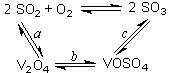
(5) 工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。将尾气通入粉末状的碳酸钙或熟石灰的悬浊液中,经过一系列处理后得到一种相对分子质量为172的化工原料J。试写出J的化学式_________。
某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
| 实验 |
药品 |
制取气体 |
量气管中的液体 |
| ① |
Cu、稀HNO3 |
NO |
H2O |
| ② |
FeCl3溶液、双氧水 |
H2O |
|
| ③ |
Zn、稀H2SO4 |
H2 |
H2O |
| ④ |
NaOH固体、浓氨水 |
NH3 |
|
| ⑤ |
Na2CO3固体、稀H2SO4 |
CO2 |
|
| ⑥ |
镁铝合金、NaOH溶液(足量) |
H2 |
H2O |
请回答下列问题:
(1)本实验应对量气管多次读数,读数时应注意
①,
②,③视线与凹液面最低处相平。
(2)实验②收集的气体是。
(3)若向实验③反应体系中加少量CuSO4溶液,反应速率加快,原因是。
(4)实验④、⑤中,量气管中的液体分别是、。
| A.稀H2SO4 | B.CCl4 | C.饱和Na2CO3溶液 | D.饱和NaHCO3溶液 |
(5)在25℃,101kPa条件下,取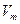 =24.0L/mol。实验⑥数据如下:
=24.0L/mol。实验⑥数据如下:
| 编号 |
镁铝合金质量 |
量气管第一次读数 |
量气管第二次读数 |
| 1 |
1.0g |
20.0mL |
382.2mL |
| 2 |
1.0g |
20.0mL |
360.0mL |
| 3 |
1.0g |
20.0mL |
377.8mL |
根据上述合理数据计算镁铝合金中铝的质量分数。
某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂从下列固物质中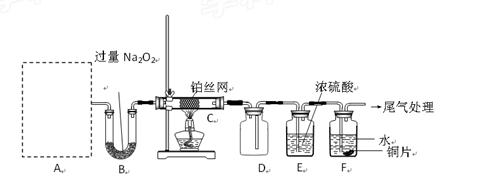
a. NH4HCO3、b. NH4Cl、c. Ca(OH)2、d. NaOH。
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是________(填备选试剂的字母);此时A中主要的玻璃 仪器有________________(填名称)。
仪器有________________(填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:_____________________。
(3)对于C中发生的可逆反应,下列说法正确的是________。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4∶5
(4)请在下图坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500mL1mol·L-1盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是____mol,甲在标准状况下是_____L(忽略气体的溶解)。