2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) ="=" 2NO2(g) ΔH= + 67.7kJ·mol-1
N2H4(g) + O2(g)="=" N2(g) + 2H2O(g) ΔH= - 534.0kJ·mol-1
2NO2(g)  N2O4(g) ΔH=" -" 52.7kJ·mol-1
N2O4(g) ΔH=" -" 52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: ;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为: ;
(3)工业上可以用下列反应原理制备氨气:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
①已知该反应的平衡常数K与温度的关系如图,则此反应的 Q 0 (填“>”“<”或“=”)。

②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为0.3mol/L,则用氧气表示的反应速率为 。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号).
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.v(N2)/v(O2)=2∶3 |
| C.容器中气体的密度不随时间而变化 |
| D.通入稀有气体能提高反应的速率 |
E.若向容器中继续加入N2,N2的转化率将增大
(4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。

①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中
c(NH4+) c(NO3-)(填“>”“<”或“=”);
②Ir—Ru惰性电极有吸附O2作用,该电极的电极反应为 ;
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为 。
Ⅰ.卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性
质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 |
现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 |
随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 |
溶液的蓝色逐渐褪去 |
请回答:
(1)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是。
(2)若用y表示锥形瓶中含碘物质的物质的量 ,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
Ⅱ.过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序:
甲同学:⑤—⑧—③—⑦—④;乙同学:⑤—③—②。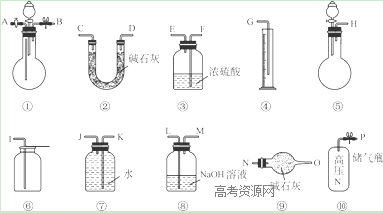
已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O。
(1)甲同学想通过实验测得的数据是____________,他选用的装置________(填序号)是没有必要的。
(2)乙同学想通过实验测得的数据是________________。有人认为按他测得的数据计算出的实验结果可能偏高,原因是________________; 为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用):________________(填序号)。
铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃-60℃的两个原因除了加快反应速率外,还有。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO, 其猜想可用化学方程式表示为:
Cu + H2SO4
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是(填字母)
a.Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式。若将上述混合物用足量的H2加热还原,所得到固体的质量为g。若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为。
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是> > 。(填化学式)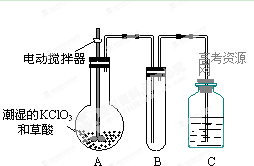
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如上图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A中反应还原剂与氧化剂的物质的量之比为1:2,该反应的化学方程式为。
A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置:;
②该装置按①补充完整后,装置A、B、C中还有一处设计明显不合理的是 _
(填“A、B或C”),理由是
③C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发该反应的离子方程式为。若实验时需要450mL 4mol/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有。
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下: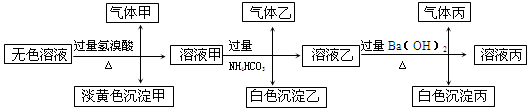
回答下列问题:
(1)生成沉淀甲的离子方程式:;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 |
实验目的 |
试剂 |
现象 |
| 1 |
|||
| 2 |
|||
| 3 |
|||
| 4 |
(2)由溶液甲生成沉淀乙的离子方程式:;
(3)综上所述,该溶液中肯定存在的离子有:。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是
。
汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+ O2(g) = 2NO(g)△H = +180.5kJ/mol
2H2(g)+ O2(g) = 2H2O(l)△H = -571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为。
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图是反应:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。