为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:
0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确? (填“正确”或“不正确”),并说明理由 。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b应满足什么关系? 。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入少量NH4Cl晶体,溶液颜色变 (填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质? (填“能”或“否”),并说明原因 。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质: 。
下图表示几种中学常见物质之间的相互转化关系(图中部分条件或产物已省略),其中B为黑色的非金属固体单质,D可使品红溶液褪色,E在通常状况下是无色无味的液体,G是淡黄色的固体化合物,H是黑色晶体。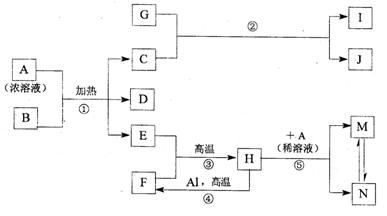
请回答下列问题:
(1)单质F的组成元素在周期表中的位置是(指明周期和族),G的电子式为,化合物Ⅰ的俗名。
(2)金属Al和H的混合物俗称,引发该反应的操作是。
(3)镁条能在气体C中燃烧得到两种固体,其化学式分别是、;
(4)写出上图中下列反应的化学方程式:
①;
③;
(5)向上图中的反应⑤得到的M、N混合液中通入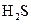 气体,溶液变浑浊,酸性增强。请写出该过程发生反应的离子方程式:。
气体,溶液变浑浊,酸性增强。请写出该过程发生反应的离子方程式:。
某同学将一废旧电解单元槽改装成如图装置,其中间的膜可以自由更换。
(1)若K处于打开状态,膜为半透膜,Ⅰ室内加入KI淀粉溶液,Ⅱ室内加入等体积的含有稀硫酸的双氧水,一段时间后可观察到的现象是(填字母序号)
| A.Ⅰ室内溶液变蓝 |
| B.Ⅱ室内溶液变蓝 |
| C.Ⅰ、Ⅱ室内溶液都变蓝 |
| D.Ⅰ、Ⅱ室内溶液都不变蓝 |
(2)若膜为阳离子交换膜(只允许阳离子自由通过且不易堵塞),Ⅰ室内加入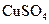 溶液,Ⅱ室内加入等体积NaCl溶液。K闭合后,开始一段时间内,Ⅰ室电极上的电极反应式为,Ⅱ室电极上的电极反应式为。
溶液,Ⅱ室内加入等体积NaCl溶液。K闭合后,开始一段时间内,Ⅰ室电极上的电极反应式为,Ⅱ室电极上的电极反应式为。
(3)若K处于打开状态,膜为阴离子交换膜(只允许阴离子自由通过且不易堵塞),Ⅰ室内加入0.1mol/L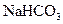 溶液,Ⅱ室内加入0.1mol/L NaOH溶液,装置内发生反应的离子方程式为。一段时间后,关闭K,则装置中Ⅰ室内产生的气体为(填化学式),Ⅱ室内产生的气体为(填化学式)。
溶液,Ⅱ室内加入0.1mol/L NaOH溶液,装置内发生反应的离子方程式为。一段时间后,关闭K,则装置中Ⅰ室内产生的气体为(填化学式),Ⅱ室内产生的气体为(填化学式)。
工业上用CO生产燃料甲醇,一定条件下发生反应: CO(g)+2H2(g)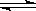 CH3OH(g)。
CH3OH(g)。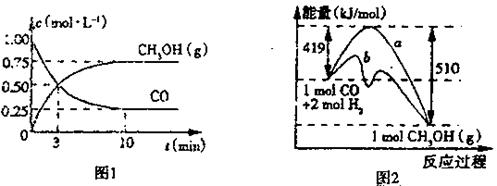
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=。
(2)图2表示该反应进行过程中能量的变化。曲线(填“a”或“b”)表示不使用催化剂时反应的能量变化,不使用催化剂时该反应的逆反应的活化能为。
(3)该反应平衡常数K的表达式为,温度升高,平衡常数K(填“增 大”、“不变”或“减小”)
大”、“不变”或“减小”)
(4)恒容条件下,下列措施中能使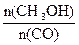 增大的有。
增大的有。
| A.升高温度 | B.充入He气 |
| C.再充入1molCO和2molH2 | D.使用催化剂 |
甲、乙、丙、丁是4种短周期元素,它们的原子序数依次增大;其中甲和丙、乙和丁分别 是同主族元素,又知乙、丁两元素的原子核中质子数和是甲、丙原子核中质子数之和的2倍,甲元素的一种同位素核内无中子。
是同主族元素,又知乙、丁两元素的原子核中质子数和是甲、丙原子核中质子数之和的2倍,甲元素的一种同位素核内无中子。
(1)过量的乙与丁组成的一种化合物通入紫色石蕊试液中的现象是。写出均含甲、乙、丙、丁四种元素的两种化合物相互间发生反应,且生成气体的离子方程式 。
。
(2)甲与乙组成的化合物与乙和丙组成的化合物反应能产生乙单质,写出该反应的化学方程式。
(3)用甲元素的单质与乙元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在A极通入甲的单质,B极通入乙的单质,则A极是该电池的极;B极的电极反应式是: 。
。
(4)将丁与乙元素以原子个数1:2组成的化合物6.4g与80mL2mol/L的NaOH溶液恰好反应,则所生成溶质总质量为g。
丙烯酰胺是一种重要的有机合成的中间体。它的球棍模型如下图所示:(图中“棍”代表单键或双键或三键,不同颜色球表示不同原子:C、H、O、N)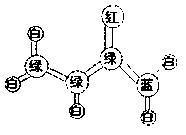
(1)丙烯酸胺的分子式为,结构简式为。
(2)有关丙烯酸胺的说法正确的是
A.丙烯酸胺分子内所有原子不可能在同一平面内
B.丙烯到胺属于烃的含氧衍生物
C.丙烯酰胺能够使酸性高锰酸钾溶液褪色
D.丙烯酸胺能够使溴的四氯化碳溶液褪色
(3)工业上生产丙烯酸胺的方法之一是 (反应均在一定条件下进行):
(反应均在一定条件下进行):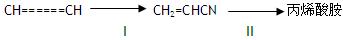
反应I和反应I I都是原子利用率100%的反应,反应I所需另一反应物的分子式为,反应II的方程式为。
I都是原子利用率100%的反应,反应I所需另一反应物的分子式为,反应II的方程式为。
(4)聚丙烯酰胺(PAM)是一种合成有机高分子絮凝剂,写出由丙烯酰胺合成聚丙烯酰胺的化学方程式并注明反应类型。