碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g) Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
| A.升高温度,正反应速率和逆反应速率都增大,平衡向右移动 |
B.缩小容器容积,平衡右移, H不变 H不变 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低,化学平衡常数增大 |
| D.当气体平均摩尔质量或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+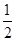 O2(g)=CO(g)
O2(g)=CO(g)  H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1
C(s)+ O2(g)=CO2(g)  H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1
S(s)+O2(g)=SO2(g)  H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1
则SO2与CO反应生成S的热化学方程式为: 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时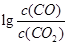 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
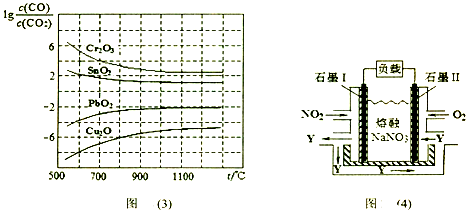
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,石墨II的电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上转移电子 mol。
X、Y、Z、W、R是五种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y元素原子的最外层电子数是其次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。请填写下列空白:
(1)画出W的原子结构示意图;。
(2)Z和W最高价氧化物的水化物的碱性较强的是:(写化学式),它们之间在溶液中反应的离子方程式是;;
(3)Z2Y2 中阴离子的化学式是。
(4)在同周期元素中,R 元素及与其相邻元素的原子半径从大到小的顺序是:。与R元素同周期且非金属性最强的元素是:。
(5)W的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,其反应的化学方程式是:。
合理、高效利用金属矿物,将其中的金属从其化合物中还原出来用于生产和制造各种金属材料,这一过程在工业上称为金属的冶炼。
(1)以HgO为原料冶炼Hg,冶炼方法是。
(2)铝热法是冶炼金属的方法之一,写出铝热法炼铁(Fe2O3)的化学方程式:。引发铝热反应的实验操作是:
。
(3)某些金属氧化物粉末和铝粉在一定条件下可以发生铝热反应。下列反应速率(υ)和温度(T)的关系示意图中与铝热反应最接近的是:(填字母)。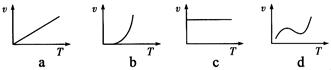
(10分) 莽草酸具有抗炎、镇痛作用,还可作为合成抗病毒和抗癌药物的中间体。莽草酸可以实现下列转化:
已知:①
请回答下列问题。
(1)A的结构简式是。
(2)B C的化学方程式是
C的化学方程式是
。
反应类型是反应。
(3)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原予称为手性碳原
子。E分子中手性碳原子有个。
(4)莽草酸经过中间产物D合成E的目的是。
(10分) 化合物A经李比希法和质谱法分析得知其分子式是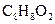 ,相对分子质量136。A的核磁共振氧谱有4个峰,峰面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有个取代基,其核磁共振氢谱与红外光谱如下图。
,相对分子质量136。A的核磁共振氧谱有4个峰,峰面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有个取代基,其核磁共振氢谱与红外光谱如下图。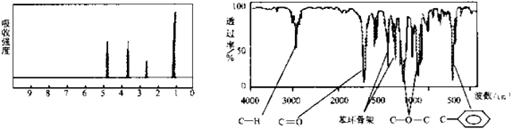
请回答下列问题。
(1)A的结构简式是。
(2)A的同分异构体(不含A) 中属于酯类的芳香族化台物共有种,请写出其
中任意两种的结构简式、。
(3)B与A互为同分异构体且能与碳酸氢钠反应,B的核磁共振氢谱也有4个峰,峰面
积之比为1:2:2:3,请参照示例写出以B和乙烯为原料在一定条件下台成聚酯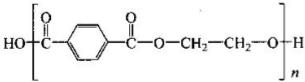 的合成路线。
的合成路线。
示例: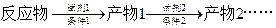
(10分) 肉桂酸是重要的有机合成中间体,广泛用于医药、香料、塑料和感光树脂等化工产品中。肉桂酸的结构简式为
请回答下列问题。
(1)肉桂酸的分子式是。
(2)写出肉桂酸的顺式结构。
(3)肉桂酸与乙醇在一定条件下发生反应的化学方程式是
。
(4)已知: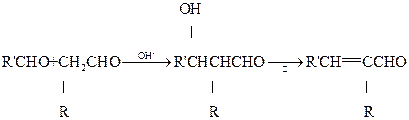
由苯甲醛制备肉桂酸的合成路线如下: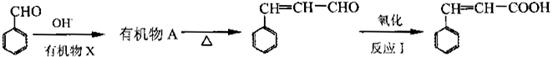
①上述合成路线中,反应I中氧化剂可选择(填写正确选项的字母)。
a.高锰酸钾酸性溶液 b.新制氧氧化铜 c.溴的四氯化碳溶液
②苯甲醛与有机物X反应生成A的化学方程式是
。