2013年三月,欧盟决定暂停征收航空碳排放税,由此可以看出人类发展与环境保护的冲突仍然尖锐,大气保护工作只能在人们的各种冲突中曲折前行。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:

上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
①计算K1= 。
②T2℃达到平衡后,增大压强至气体体积为1L。新平衡体系中NO的平衡浓度c(NO)= 。
(2)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
①CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:②2H2O (g) ="=" 2H2 (g) + O2 (g) ΔH=+484 kJ/mol,
写出CO完全燃烧生成CO2的热化学方程式: 。
(3)现以CO、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备高铁酸盐Na2FeO4的装置如图所示。其中Y为CO2。

写出石墨I电极上发生反应的电极反应式 。
写出电解池中生成FeO42-的电极反应式为 。
(4)高铁酸钾是一种新型水处理剂,它既有杀菌消毒的功能,又有净水的功能,请根据所需知识简要解释其净水的原理: 。
(本题共15分)锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
已知:① 经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
② SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③ SrCl2·6H2O的摩尔质量为:267 g/mol。
(1)天青石焙烧前先研磨粉碎,其目的是_________________________________________。
(2)隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_____________________________________________。
(3)为了得到较纯的六水氯化锶晶体,过滤2后还需进行的两步操作是_______________。
(4)加入硫酸的目的是______________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(5)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______(保留4位有效数字)。
(14分)(1)实验室用锌片和稀硫酸反应制取氢气.并验证氢气的还原性及回收硫酸锌晶体。
①若用上述各仪器,则各仪器的连接顺序为,装置E中盛放的试剂为,C装置的作用是。
②锌与硫酸反应制取氢气后的溶液中。常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从适量BaCl2溶液、适量Zn粉、适量NaOH溶液三种试剂中选用一种试剂除杂,该试剂为。
(2)工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4·7H20的流程如下。
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为3.76.5 9.7 。
①为了提高酸浸效率,可以采取的措施有。
②加入适量锌粉的作用为。
③氧化过程中加人H202发生反应的离子方程式为。
④由滤液得到ZnS04·7H2O的操作依次为、、过滤、洗涤、干燥。
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①下列收集Cl2的正确装置是 。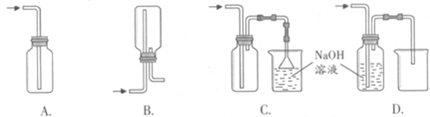
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 。
(2)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图,并作相应标注。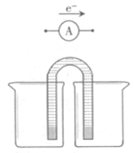
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选 作阳极。
尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为 。
(2)当氨碳比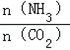 =4时,CO2的转化率随时间的变化关系如图1所示.
=4时,CO2的转化率随时间的变化关系如图1所示.
①A点的逆反应速率v逆(CO2) B点的正反应速率v正(CO2)(填“大于”“小于”或“等于”)。
②NH3的平衡转化率为 。
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.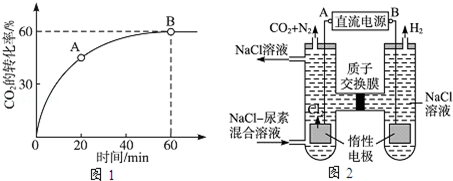
①电源的负极为 (填“A”或“B”).
②阳极室中发生的反应依次为 、 .
③电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44L(标准状况),则除去的尿素为 g(忽略气体的溶解).
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×l04C.mol-1,列式计算),最多能产生的氯气体积为 L(标准状况)。